Kalciumsulfid (CAS) struktur, egenskaper, erhållning, användning
- 3031
- 437
- Lars Eriksson
han Kalsulfid Det är ett oorganiskt fast ämne som bildas av kalciumelementet (CA) och svavelelementet (er), av kemisk formel är CAS CAS. Det är ett gulaktigt vitt lösligt fast ämne i vatten, som finns i naturen i vissa vulkaner och i vissa meteoriter i form av ett mineral som heter Oldhamite.
Cas vid upplösning i vatten bildar olika föreningar eftersom svaveljonerna s2- blir jon sh- och OH -joner bildas-. Den resulterande lösningen är alkalisk. Denna förening används som bas för självlysande föreningar eller som ger synligt ljus under vissa förhållanden. Dessa material används också i ljusmålningar.
 Cas kalciumsulfid har hittats i vissa meteoriter. Författare: рote жравёв. Källa: Pixabay.
Cas kalciumsulfid har hittats i vissa meteoriter. Författare: рote жравёв. Källa: Pixabay. CAS har betraktats som möjligt medicin för att behandla hjärtproblem och blodkärl som hypertoni eller högt tryck, som är en sjukdom som påverkar en stor del av världens befolkning.
Med kalciumsulfid kan andra föreningar såsom kalciumnitrat och kalciumkarbonat erhållas. Det måste hanteras med försiktighet och i kontakt med atmosfärens fukt kan producera h2S som är mycket giftigt.
[TOC]
Strukturera
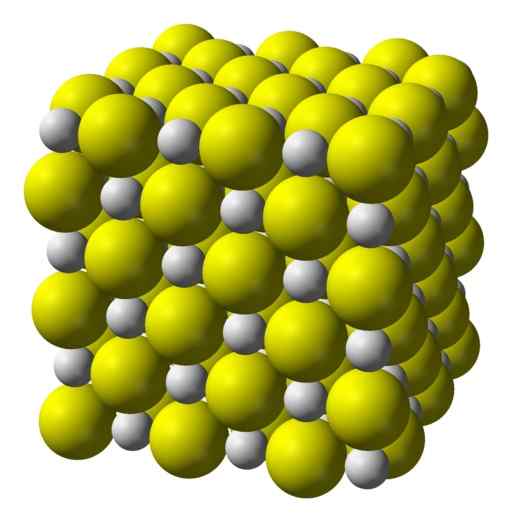
Kalciumsulfid är en mycket jonisk förening bildad av en CA -kalciumjon2+ och en sulfidjon S2-.
Kristalliseras i en kubisk struktur som bergsalt.
 Kubisk kristallin struktur av kalciumsulfid. Gul = svavel; Vit = kalcium. Benjah-Bmm27 / allmän domän. Källa: Wikimedia Commons.
Kubisk kristallin struktur av kalciumsulfid. Gul = svavel; Vit = kalcium. Benjah-Bmm27 / allmän domän. Källa: Wikimedia Commons. Nomenklatur
- Kalsulfid
Fysikaliska egenskaper
Fysiskt tillstånd
Gulaktigt vitt kristallint fasta, kubiska kristaller såsom natriumklorid.
Molekylvikt
72,144 g/mol
Smältpunkt
2528 ºC
Densitet
2,59 g/cm3
Löslighet
Löslig i vatten. Olöslig i etanol.
Kemiska egenskaper
Vattenlösning
Vid upplösning i vatten separeras CAS i sina kalcium CA -joner 2+ och sulfid S2-. Det senare i vatten tar en proton och blir shh hydrosulfurojon- släpper en OH -hydroxyljon-.
Kan tjäna dig: siktadS2- + H2Eller ⇔ sh- + Åh-
Därför är kalciumsulfidlösningar alkaliska (de har grundläggande pH) och har inte sjoner2- Men sh-.
Endast i händelse av att en stor mängd alkali läggs till lösningen såsom NaOH -natriumhydroxid. Balansen rör sig mot bildandet av svaveljoner S2-.
 Kalciumsulfid upplöses i vatten som bildar andra föreningar. Författare: Clker-fri-vektorbilder. Källa: Pixabay.
Kalciumsulfid upplöses i vatten som bildar andra föreningar. Författare: Clker-fri-vektorbilder. Källa: Pixabay. Sh- Du kan ta en annan proton h+ vatten, bildar vätesulfid, vilket är en mycket toxisk förening.
Sh- + H2Eller ⇔ h2S + Oh-
Därför är små mängder H -form i vatten2S och genom att bli utsatt för miljöens fuktighet, avger CAS en obehaglig lukt som är typisk för vätesulfid.
Föreningar närvarande vid upplösning i vatten
Resultatet av de tidigare angivna vattenreaktionerna är att Ca (SH) bildas2, Ca (oh)2 och CA (SH) (OH).
Cas + h2O → CA (SH) (OH)
CA (SH) (OH) + H2O → CA (OH)2 + H2S
Syra reaktion
Samma reaktioner som förekommer i vatten gör att CAS reagerar med syror som bildar h2S.
CAS + 2 HCl → CaCl2 + H2S
Andra reaktioner
Om en kalciumsulfidlösning med svavel värms upp, erhålls polysulfidjonerna42- och s32-.
Om CAS upphettas i torr luft eller rent syre oxideras föreningen till kalciumsulfitfodral3 Och sedan till kalciumsulfatfodral4:
2 cas + 3 o2 → 2 Fall3
2 -fall3 + ANTINGEN2 → 2 Fall4
Med oxiderande medel som KCLO kaliumklorat3, Kno kaliumnitrat3 eller blydioxid2 Våldsamma reaktioner inträffar.
Erhållande
Kalciumsulfid kan framställas genom kalkning (uppvärmning vid mycket hög temperatur) Kalcium (CA) och svavel (er) i inert atmosfär, det vill säga de är inte närvarande till exempel syre eller vattenånga.
Det kan tjäna dig: klorsyra (HCLO2)CA + S + värme → CAS
Kan också erhållas genom uppvärmning av kalciumsulfatfodral4 Med kol:
Fall4 + 2 c → cas + 2 co2
I det senare fallet erhålls emellertid inte ett rent hus, eftersom det reagerar dessutom med fallet4 bildar cao och så2.
CAS genereras också genom att bränna kolavfall.
Närvaro
CAS är naturligt närvarande i Oldhamite Mineral. Detta är en del av vissa meteoriter och är viktig av den vetenskapliga forskningen som utförs på solsystemet.
Det tros att Oldhamita bildades av kondens i nebulan som har sitt ursprung i solsystemet. Det finns också i vulkaner.
 Cas kalciumsulfid finns i Oldhamite Mineral, som har hittats i vissa meteoriter. Leon Hupperichs/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/3.0). Källa: Wikimedia Commons.
Cas kalciumsulfid finns i Oldhamite Mineral, som har hittats i vissa meteoriter. Leon Hupperichs/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/3.0). Källa: Wikimedia Commons. Dessutom produceras kalciumsulfid naturligtvis genom att minska fallet4 (gips) eventuellt genom verkan av bakterier.
Ansökningar
I lätta material
En av de mest utbredda användningarna av kalciumsulfid har varit som grund för lätta föreningar. Det här är ämnen som avger synligt ljus under vissa omständigheter.
I de självlysande föreningarna av CAS fungerar detta som bas och aktivatorer läggs till strukturen såsom klorider för vissa element såsom Cerio (CE3+) och Europio (EU2+).
Materialet som härrör från CAS -unionen och aktivatorn används till exempel i katodstrålarnas skärmar som utgör de gamla skärmarna av datorer eller datorer eller gamla TV -enheter.
 Forntida datorer Monitorer hade katodstrålrör där ibland självlysande föreningar av kalciumsulfid och aktivatorer används ibland. Författare: Andreas160578. Källa: Pixabay.
Forntida datorer Monitorer hade katodstrålrör där ibland självlysande föreningar av kalciumsulfid och aktivatorer används ibland. Författare: Andreas160578. Källa: Pixabay. De används också i de aktuella lamporna med ljusemitterande dioder eller LED (akronym för engelska Ljusdioder).
Kan tjäna dig: ayaroína LED lampa. Vissa kan innehålla självlysande föreningar av kalciumsulfid. Ingen maskinläsbar författare tillhandahållen. Apper antog (baserat på upphovsrättsanspråk). /CC BY-SA (http: // Creativecommons.Org/licenser/BY-SA/3.0/). Källa: Wikimedia Commons.
LED lampa. Vissa kan innehålla självlysande föreningar av kalciumsulfid. Ingen maskinläsbar författare tillhandahållen. Apper antog (baserat på upphovsrättsanspråk). /CC BY-SA (http: // Creativecommons.Org/licenser/BY-SA/3.0/). Källa: Wikimedia Commons. Dessa material används också i ljusmålningar och lack.
Inom medicin
Kalciumsulfid har betraktats i medicinska studier som ett läkemedel för att behandla arteriell hypertoni (högt tryck i artärer). Detta är en sjukdom som påverkar det kardiovaskulära systemet för många människor (hjärt- och blodkärl).
Cas betraktas som en "givare" av h2S. Detta spelar en viktig roll för att reglera tonen eller styrkan hos blodkärl, så CAS -administrationen kan vara ett möjligt botemedel för att behandla hypertoni.
 Kalciumsulfid har studerats som ett möjligt botemedel mot det höga trycket i det kardiovaskulära systemet för sjuka människor. Författare: Mohamed Hassan. Källa: Pixabay.
Kalciumsulfid har studerats som ett möjligt botemedel mot det höga trycket i det kardiovaskulära systemet för sjuka människor. Författare: Mohamed Hassan. Källa: Pixabay. För att få andra föreningar
Kalciumsulfid gör det möjligt att framställa andra föreningar såsom kalciumnitrat CA (Nej3)2:
Cas + 2 hno3 → CA (nej3)2 + H2S
Det har också använts för att erhålla Caco kalciumkarbonat3. För detta skickas en vattenlösning av CAS till kol2:
Cas + h2Eller + co2 → H2S + Caco3
Andra appar
Kalciumsulfid används också som tillsatsmedel för smörjmedel och som ett flotationsmedel i mineralekstraktion.
Risker
Kalciumsulfid kan orsaka hud, ögon och luftvägar irritation. Måste manipuleras med försiktighetsåtgärder och korrekt säkerhetsredskap.
Det är en mycket giftig förening för vattenlevande liv, så det är farligt för dessa miljöer.
Referenser
- Bomull, f. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- Bly, D.R. (redaktör). (2005). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Ropp, r.C. (2013). Grupp 16 (O, S, SE, TE) alkaliska jordföreningar. Sulfidkalcium. I encyklopedi av de alkaliska jordföreningarna. Återhämtat sig från Scientedirect.com.
- Li och.F. et al. (2009). Kalciumsulfid (CA), till givare av vätesulfid (H (2) s): En ny antihypertensiv drarug? Med Hypothes, 2009 september; 73 (3): 445-7. NCBI återhämtade sig.Nlm.Nih.Gov.
- Hus j.OCH. och hus, k.TILL. (2016). Svavel, selen och tellur. Förekomma i svavel. I beskrivande oorganisk kemi (tredje upplagan). Återhämtat sig från Scientedirect.com.
- ELLER.S. National Library of Medicine. (2019). Kalsulfid. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Öl, m. et al. (2014). Omvandling av kalciumsulfid till kalciumkarbonat under processen för återhämtning av elementärt svavel från gipsavfall. Waste Manag, 2014 nov; 34 (11): 2373-81. NCBI återhämtade sig.Nlm.Nih.Gov.
- « Kvantitativa forskningsegenskaper, tekniker, exempel
- Kalciumsilikategenskaper, struktur, erhållning, användning »

