Zinksulfid (ZnS)
- 4037
- 1152
- PhD. Lennart Johansson
 Zinksulfid. Källa: Wikimedia Commons
Zinksulfid. Källa: Wikimedia Commons Vad är zinksulfid?
han Zinksulfid Det är en oorganisk förening av formel znS, bildad av Zn -katjoner2+ och anions s2-. Det finns i naturen främst som två mineraler: Wurtzite och Spheny (eller Zink Blenda), den senare är dess huvudform.
Sphenhell presenteras i den svarta naturen på grund av de föroreningar som den presenterar. Rent presenterar vita kristaller, medan Wurtzita har gråaktiga vita kristaller.
Zinksulfid är olöslig i vatten. Det kan orsaka miljöskador, eftersom det penetrerar marken och förorenar grundvatten och deras strömmar.
Zinksulfid kan inträffa bland andra reaktioner, korrosion och neutralisering.
Av korrosion:
Zn +h2S => ZnS +H2
Genom neutralisering:
H2S +Zn (OH)2 => ZnS +2H2ANTINGEN
Zinksulfid är ett fosforescerande salt, vilket ger det kapaciteten för flera användningsområden och applikationer. Dessutom är det en halvledare och en fotokatisering.
Zinksulfidstruktur
Zinksulfid antar kristallina strukturer som styrs av elektrostatiska attraktioner mellan Zn -katjonen2+ och anion s2-. Dessa är två: Spheny eller Zink Blenda och Wurzita. I båda jonerna minimerar avvisningar mellan lika joner.
Zink Blenda är den mest stabila i markförhållandena för tryck och temperatur; Och Wurzita, som är mindre tät, är resultatet av den kristallina omorganisationen på grund av temperaturökningen.
De två strukturerna kan samexistera i samma ZnS -fasta samtidigt, även om Wurzita mycket långsamt kommer att hamna främst.
Zinkblenda
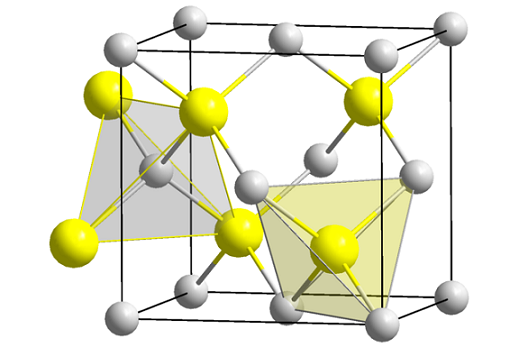
 Zink Blenda Structure (Spheny). Källa: Wikimedia Commons
Zink Blenda Structure (Spheny). Källa: Wikimedia Commons Den överlägsna bilden visar kubikcellen centrerad på ansikten på zinkblendstrukturen. De gula sfärerna motsvarar S -anjonerna2-, och grå till Zn -katjoner2+, beläget i hörnen och i kubens centra.
Kan tjäna dig: isobutil: nomenklatur, träning, struktur och egenskaperNotera de tetraedrala geometrierna runt jonerna. Zink Blenda kan också representeras av dessa tetraedra, vars hål inuti glaset har samma geometri (tetraedrala hålar).
ZnS -andelen uppfylls också inom enhetscellerna; det vill säga en proportion 1: 1. Således för varje Zn -katjon2+ Det finns en anjon2-. På bilden kan det tyckas att grå sfärer finns i överflöd, men i verkligheten när de är i hörnen och mitten av navytorna delas de av andra celler.
Till exempel, om de fyra gula sfärerna som finns inne i lådan tas, bör "bitarna" av alla grå sfärer runt till samma (och göra det), fyra. Således finns det i den kubiska enhetscellen fyra Zn2+ och fyra s2-, ZnS -stökiometriska andelen är uppfylld.
På samma sätt är det viktigt att betona att det finns tetraedriska hål framåt och bakom de gula sfärerna (utrymmet som skiljer dem från varandra).
Wurzita
 Wurzitstruktur. Källa: Wikimedia Commons
Wurzitstruktur. Källa: Wikimedia Commons Till skillnad från strukturen på zinkblendan antar Wurzita ett hexagonalt kristallint system (överlägsen bild). Detta är mindre kompakt, så det fasta ämnet har mindre densitet.
Jonerna i Wurzita har också tetraedriska miljöer och en 1: 1 -andel som överensstämmer med ZnS -formeln.
Zinksulfidegenskaper
Färg
Det kan presenteras på tre sätt:
-Wurtzita, av vita och hexagonala kristaller.
-Sphenhell, av vit-lican kristaller och kubiska kristaller.
-Som en vit till gråaktig eller gulaktig vit pulver och kubikguliga kristaller.
Smältpunkt
1.700 ° C.
Vattenlöslighet
Praktiskt taget olöslig (0,00069 g/100 ml vid 18 ° C).
Löslighet
Olöslig i alkalis, löslig i utspädda mineralsyror.
Densitet
Sfärer 4,04 g/cm3 och Wurtzita 4,09 g/cm3.
Hårdhet
Den har en hårdhet på 3 till 4 på Mohs -skalan.
Stabilitet
När man innehåller vatten oxiderar långsamt sulfat. I en torr miljö är det stabilt.
Sönderfall
När han värms upp vid höga temperaturer avger han giftig zink och svaveloösa oxider ångor.
Det kan tjäna dig: natriumhydrid (NAH): egenskaper, reaktivitet, faror, användningarZinksulfid nomenklatur
Den elektroniska konfigurationen av Zn är [AR] 3D104S2. När du förlorar de två elektronerna i 4S -omloppet är det som Zn -katjonen2+ Med sina orbitaler i full. Därför, sedan elektroniskt Zn2+ Det är mycket mer stabilt än Zn+, Den har bara en valens på +2.
Därför utelämnas den för lager nomenklaturen, tillägg av sin valens innesluten inom parentes och med romerska antal: zinksulfid (II).
Systematiska och traditionella nomenklaturer
Men det finns andra sätt att ringa Zns utöver den som redan har tagits upp. I det systematiska specificeras antalet atomer i varje element med de grekiska numeratorerna, med det enda undantaget av elementet till höger när det bara är ett. Således heter ZnS: bulleZinksulfid (och inte monozinc monosulfuro).
När det gäller den traditionella nomenklaturen, till zinken när du har en enda valens på +2, läggs den till genom att lägga till suffixet -CO. Följaktligen är dess traditionella namn: Zínc -sulfidICO.
Zinksulfidanvändning
Som pigment eller beläggningar
Bark
Sachtholith är ett vitt pigment tillverkat med zinksulfid. Det används i putties, mastiques, tätningsmedel, nedre skydd, latexfärger och skyltar.
Dess användning i kombination med absorberande pigment av ultraviolett ljus, såsom mikrotitan eller transparenta järnoxidpigment, är nödvändig i väderresistenta pigment.
Zns och latexmålningar
När ZnS appliceras i latex eller strukturerade målningar har den förlängd mikrobicidåtgärder.
Windows and Aircraft -ramar
På grund av dess stora hårdhet och motstånd mot brott, erosion, regn eller damm, gör det det lämpligt för yttre infraröda fönster eller i flygplansramarna.
Beläggning och andra användningsområden
ZnS används vid beläggning av rotorer som används vid transport av föreningar, för att minska slitage. Dessutom används det vid produktion av tryckt bläck, isolerande föreningar, termoplastisk pigmentering, plast som är resistent mot elektroluminescerande lågor och lampor.
Kan tjäna dig: Tunsen lättare: egenskaper, funktioner, exempel på användningNattvisionsapparater och skärmar
-Zinksulfid kan vara transparent, att kunna användas som fönster för synlig optik och infraröd optik. Det används i Night Vision -enheter, på TV -skärmar, radarskärmar och fluorescerande beläggningar.
Elektroluminescens
ZnS -doping med CU används vid produktion av elektroluminescenspaneler. Dessutom används det i raketframdrivning och gravimetri.
För dess fosforescens
Dess fosforescens används för att färga klocknålarna och därmed visualisera tiden i mörkret; Även i målningar för leksaker, nödsignaler och trafikmeddelanden.
Fosforescens tillåter användning av zinksulfid i katodstrålarör och på x -ray -skärmar att lysa i mörka punkter. Fosforescensens färg beror på den använda aktivatorn.
Halvledare, fotokatisering och katalysator
- Spheny och Wurtzite är bredbands klyftledare. Sphaleriten har en 3,54 eV -band klyftan, medan Wurtzita har en 3,91 eV -bandbit.
- ZnS används vid framställning av en fotokatalysator som består av CD -skivor - ZnS/Zirconium - titanfosfat, som används för väteproduktion under synligt ljus.
- Ingriper som en katalysator för nedbrytning av organiska föroreningar. Det används vid framställningen av en färgsynkroniserare i LED -lampor.
- Dess nanokristaller används för ultrasvig proteindetektion. Till exempel genom att utfärda kvantpunkter av ZnS. Det används vid framställningen av en kombinerad fotokatalysator (CDS/ZnS) -TIO2 för elektrisk produktion via fotoelektrokatalys.
Referenser
- Pubchem (2018). Zinksulfid. Taget från: pubchem.Ncbi.Nlm.Nih.Gov
- Quiminet (16 januari 2015). Vitt pigment baserat på zinksulfid. Återhämtat sig från: Quiminet.com
- Wikipedia (2018). Zinksulfid. Taget från: i.Wikipedia.org
- II-VI UK (2015). Zinksulfid (ZnS). Taget från: ii-vi.är
- Rob Toreki (30 mars 2015). Zincblende (ZnS) struktur. Taget från: ilpi.com
- Chemistry Librettexts (22 januari 2017). Structure-Zinc Blende (ZnS). Taget från: Chem.Librettexts.org
- Reade (2018). Sulfid sulfid/ zink (ZnS). Taget från: Reade.com

