Kvantbord
- 2286
- 685
- Prof. Erik Johansson
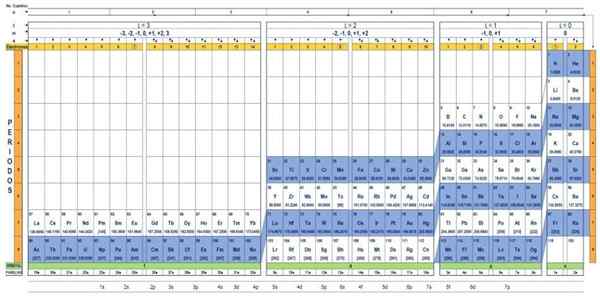
 Elementens kvanttabell. Källa: UNAM.
Elementens kvanttabell. Källa: UNAM. Vad är kvanttabellen?
De Kvantbord Det är ett sätt att organisera de kemiska elementen, utformade för att enkelt bestämma uppsättningen kvantantal som kännetecknar var och en av dem.
Forskare har funnit att det i alla elements natur finns vissa mönster. Bland dessa mönster är kvantnummer, fyra enkla nummer som beskriver den elektroniska konfigurationen för varje element.
Kvantantal uppstår naturligt från atomens mekaniska-mekaniska modell och betecknas med bokstäver: n, ℓ, mℓ och s. De beskriver energistatusen för elektroner i atomen för varje kemiskt element.
Genom det traditionella periodiska tabellen och några ytterligare verktyg är det möjligt att ha den elektroniska konfigurationen av atomen för alla element. Fördelen med kvanttabellen är att elementen är organiserade på ett sådant sätt att deras kvantantal omedelbart syns, utan att behöva göra många beräkningar separat.
Kvanttabellens egenskaper
Det finns flera kvanttabeller. Modellen som visas i figuren ovan innehåller:
- En rubrik med fyra rader, med värdena på de fyra kvantantalet, n, ℓ, m och s, plus en femte rad i gult, vilket motsvarar antalet elektroner i den yttersta omloppet.
- Bordets kropp, som består av ett rutnät som innehåller symbolen för det kemiska elementet, börjar med väte, i den näst sista kolonnen i höger, följt av heliumet, och så vidare. Numret nedan representerar mängden atomelektroner i ett grundläggande tillstånd.
- Längst ner, i den gröna raden finns det fyra klasser för att organisera elementen: orbitalerna S, P, D och F (från vänster till höger).
- Slutligen, under omloppet är familjen. Varje kolumn är en familj, numrerad från 1 till 32. Till exempel tillhör 1: a och 2: a familjer till S -klassen, familjer från 3: e till 8A, tillhör klass P, och så vidare.
Vad är kvanttabellen för?
Kvanttabellen tjänar till att hitta uppsättningen kvantnummer som kännetecknar en elektron från atomen. Normalt kommer dessa elektroner att vara de i det yttersta lagret, eftersom det är de som definierar elementets kemiska beteende.
Hur är kvanttabellen?
Kvanttabellen gör det enkelt att hitta kvantantalet på elektronerna i atomens yttersta lager.
Exempel 1
För att illustrera proceduren tas aluminiumelementet som ett exempel, vars symbol är till. Det första steget är att hitta det i kvanttabellen och markera den med en Röda cirkel:
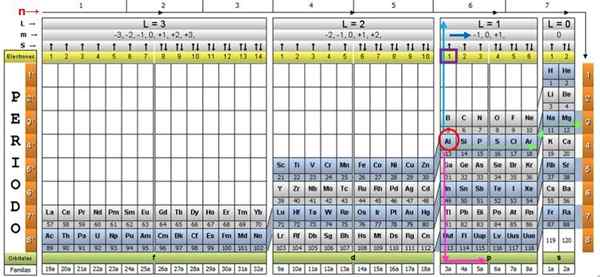
Steg 1: Hitta n
Efter att ha lokaliserat elementet i tabellen måste du gå igenom samma rad och färg, till höger, tills du når den orange kolonnen, efter den gröna pilens väg som visas i bilden.
Pilen pekar på den markerade rutan med nummer 3, som är det huvudsakliga kvantantalet N:
n = 3
Steg 2: Hitta ℓ
För att bestämma det sekundära kvantantalet följs den blå vertikala pilen, vilket indikerar:
ℓ = 1.
Steg 3: Hitta m
Den yttre aluminiumelektronen finns i pubilling P -familjen, som kan läsas i den gröna raden, till vilken den rosa pilen punkter.
Dessutom läses mängden elektroner i det sista skiktet i rubrikens gula rad. När det gäller aluminium finns det en elektron (markerad på Purple Square), vilket är referensen. Genom att kombinera ovanstående resultat är konfigurationen för det sista lagret:
Kan tjäna dig: galvanisk cell: delar, hur fungerar, applikationer, exempel3p1
Det är känt att ett P -skikt stöder högst 6 elektroner. Och antalet M tar några av hela värdena - ℓ, ( - ℓ+1), ... 0, ... (+ℓ −1),+ℓ.
Som i detta fall ℓ = 1, då kan m vara −1, 0, 1.
Dessa siffror visas i rubrikraden motsvarande M (se i bilden Horisontell pil blå). Följande tabell fungerar som en guide för att veta vad som är värdet av att välja, beroende på fallet:
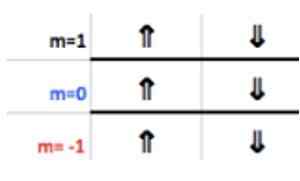
Eftersom det sista aluminiumskiktet har 1 elektron, motsvarar det magnetiska kvantantalet
m = 1.
Steg 4: Hitta s
Spinnumret S har bara två värden: +½ eller - ½. I topplådan, om pilen indikerar, väljs den S = +½ och om den pekar ner, så s = - ½. När det gäller aluminium pekar elektron 1 därför:
S = + ½.
Kort sagt, kvantantalet för elektronen i det yttersta skiktet av aluminium till ljudet:
n = 3; ℓ = 1; M = 1, s = +½
Exempel 2 (exceptionella fall)
Silver AG, och cirka tjugo element, är exceptionella fall, så man måste vara försiktig när man använder kvanttabellen med dem.
Om den tidigare proceduren upprepas skulle AG erhållas som en sista undernivå på 4D9.
Detta beror på att den förutsagda konfigurationen av La Plata, enligt Madelungs styre, är:
1s2 2s2 2 p6 3s2 3p6 4S2 3D10 4p6 5S2 4d9
I praktiken följer emellertid inte denna konfiguration exakt, och inte heller andra element vars senaste förutsagda lager är 4D9, som koppar och guld, bland andra (konsultera Internet för att få en komplett lista över element som inte följer Madelungs regel).
Kan tjäna dig: MolealityDen verkliga konfigurationen av AG är:
1s2 2s2 2 p6 3s2 3p6 4S2 3D10 4p6 5S1 4d10
Där en elektron i 5S -skiktet2 hoppade till 4D -lagret9 för att slutföra det. På detta sätt ökar atomens stabilitet. Därför är den sista undernivån verkligen:
5S1
Och dess kvantantal skulle vara de som motsvarar RB -elementet, som visas i en lila låda, med orange pilar som pekar på de återstående siffrorna:
n = 5; ℓ = 0; m = 0; S = +½
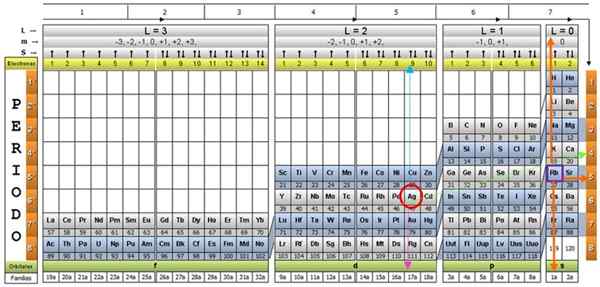 Genom att granska den periodiska tabellen ser man i själva verket att AG är i period 5, en karakteristisk bestämd av huvudkvanten numret n.
Genom att granska den periodiska tabellen ser man i själva verket att AG är i period 5, en karakteristisk bestämd av huvudkvanten numret n.
Skillnader med den periodiska tabellen
Båda tabellerna är två sätt att organisera de kemiska elementen beroende på egenskaperna hos deras atomer:
-I den periodiska tabellen har elementen som finns i samma kolumn liknande kemiska egenskaper. Till exempel börjar det med kolumnen Alkaline Metals till vänster och slutar den för de ädla gaserna till höger. Medan i raden är elementen med samma högre energinivå.
-Kvanttabellen har en stegad disposition, utformad enligt fyllningsreglerna. Därför måste du följa stegen för att få huvudnumret, utom för undantag som silver, i exemplet i föregående avsnitt. Familjerna till element i denna tabell är relaterade genom den övre omloppet, i S, P, D eller F.
Referenser
- Chang, R. 2013. Kemi. 11VA. Utgåva. McGraw Hill Education.
- Elektronisk konfiguration. Elektronisk konfiguration och kvantantal. Hämtad från: configuionectronica.com.
- Kemihandbok. Hämtad från: DCB.teknik.Unk.mx.
- Officiell kemi. Hur man enkelt kan enkelt kvantantal. Hämtad från: kemi officiell.com
- Triplenlace. Undantag från Madelungs regel i den elektroniska konfigurationen av kemiska element. Hämtad från: triplenlace.com.

