Molekylär kinetisk teori historia, postulat och exempel

- 4332
- 860
- Anders Svensson
De Molekylär kinetisk teori Det är en som försöker förklara de experimentella observationerna av gaser ur ett mikroskopiskt perspektiv. Det vill säga, det försöker associera naturen och beteendet hos gasformiga partiklar, med de fysiska egenskaperna hos gas som vätska; Förklara makroskopiska från mikroskopiska.
Gaser har alltid varit intresset för forskare på grund av deras egenskaper. De upptar hela volymen på behållaren där de är och kan komprimera helt utan att deras innehåll motsätter sig det lägre motståndet; Och om temperaturen ökar börjar behållaren expandera och kan till och med spricka.
 Gasformiga partiklar under avlägsna förhållanden eller nära kondensering. Källa: Olivier Cleynen och användare: Sharayanan [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Gasformiga partiklar under avlägsna förhållanden eller nära kondensering. Källa: Olivier Cleynen och användare: Sharayanan [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] Många av dessa egenskaper och beteenden sammanfattas i lagarna om idealiska gaser. De betraktar emellertid gas som en helhet och inte som en uppsättning miljoner spridda partiklar i rymden; Dessutom ger det inte, från tryck- och temperaturdata från tryck, mer information om hur dessa partiklar rör sig.
Det är så då att molekylär kinetisk teori (TCM) föreslår att visualisera dem som mobila sfärer (överlägsen bild). Dessa sfärer kolliderar med varandra och väggarna godtyckligt och upprätthåller en linjär bana. Men när temperaturen minskar och trycket ökar blir sfärernas bana.
En gas, enligt TCM, måste bete sig som sfärerna i den första bildrutan. Men när de kyls och ökar trycket på dem rör sig deras beteende bort från idealet. De är sedan riktiga gaser, nära kondensering och går till vätskefasen.
Under dessa förhållanden blir interaktioner mellan sfärerna viktigare, så att deras hastigheter tillfälligt långsamt. Ju närmare de är från flytande, desto fler kurvor blir deras banor (höger låda) och deras kollisioner är mindre energi.
[TOC]
Historia
Daniel Bernoulli
Idén om dessa sfärer, bättre kallade atomer, hade redan beaktats av den romerska filosofen Lucretius; Inte för gaser, utan för fasta, statiska föremål. Å andra sidan, 1738, använde Daniel Bernoulli atomvisionen på gaser och vätskor genom att föreställa dem som oordningliga sfärer som rör sig i alla riktningar.
Hans arbete kränkte emellertid fysikens lagar vid den tiden; En kropp kunde inte röra sig för evigt, så det var omöjligt att tro att en uppsättning atomer och molekyler kolliderade med varandra utan förlust av sin energi; det vill säga att förekomsten av elastiska kollisioner inte var möjlig.
Rudolf Clausius
Ett sekel senare förstärkte andra författare TCM med en modell där gasformiga partiklar rörde sig i en riktning. Rudolf Clausius sammanställde emellertid sina resultat och beväpnade en mer fullständig modell av TCM som den försökte förklara de ideala gaslagarna som visas av Boyle, Charles, Dalton och Avogadroro.
Kan tjäna dig: Coulombimetry: Fundamentals, Types, ApplicationsJames Clerk Maxwell och Ludwig Boltzmann
1859 uttalade James Clerk Maxwell att gasformiga partiklar uppvisar ett antal hastigheter vid en given temperatur, och att en uppsättning av dem kan övervägas med hjälp av en genomsnittlig molekylhastighet.
Sedan 1871 kopplade Ludwig Boltzmann befintliga idéer med entropi och hur termodynamiskt alltid tenderar att uppta det maximala möjliga utrymmet på ett homogent och spontant sätt.
Postulat molekylär kinetisk teori
Att överväga gas från dess partiklar uppfylls en modell där vissa postulat eller antaganden uppfylls; Postulerade att logiskt borde kunna förutsäga och förklara (så trogna som möjligt) de makroskopiska och experimentella observationerna. Som sagt nämns och beskrivs postulaten för TCM.
Volymen av gasformiga partiklar är försumbar
I en behållare full av gasformiga partiklar sprider de och flyttar bort mellan dem genom alla hörn. Om de för ett ögonblick alla kunde träffas vid en specifik punkt i behållaren, utan kondensering, skulle det observeras att de knappt upptar en föraktlig del av behållarens volym.
Det betyder att i behållaren, även om den innehåller miljoner gasformiga partiklar, är den verkligen mer tom än full (volym-vacío-förhållande mycket mindre än 1); Därför, om hans hinder tillåter det, kan han och gas inuti komprimeras plötsligt; Eftersom partiklarna är mycket små, precis som deras volym.
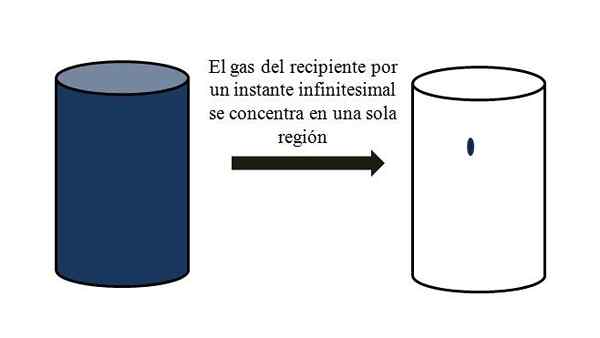 Volym-vacío-relation mellan en gas i en behållare. Källa: Gabriel Bolívar.
Volym-vacío-relation mellan en gas i en behållare. Källa: Gabriel Bolívar. Den överlägsna bilden illustrerar exakt vad som kommenteras ovan med hjälp av en blåaktig gas.
Attraktionen mellan partiklarna är noll
Gasiska partiklar inuti behållaren kolliderar med varandra utan tillräcklig tid för att deras interaktioner blir styrka; Ännu mindre när det som huvudsakligen omger dem är molekylär tom. En omedelbar konsekvens av detta är att deras linjära banor tillåter dem att täcka behållarens helt volym.
Om ovanstående inte var så, skulle en "bisar" och "labyrintisk" behållare ha våta regioner till följd av gaskondensation; Istället reser partiklarna hela behållaren med full frihet, utan styrkan i deras interaktioner som stoppar dem.
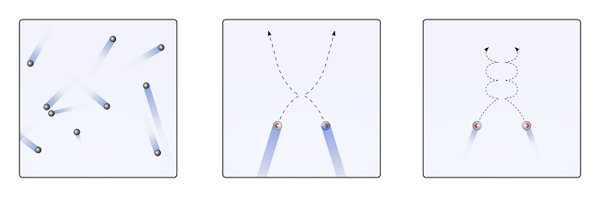
Kan tjäna dig: klorsyra (HCLO3) Disposser av gasformiga partiklar när interaktionerna är noll eller obetydliga (till., linjär), och när de är viktiga (b., kurvor). Källa: Gabriel Bolívar.
Disposser av gasformiga partiklar när interaktionerna är noll eller obetydliga (till., linjär), och när de är viktiga (b., kurvor). Källa: Gabriel Bolívar. De övre bildens linjära banor (a.) demonstrera detta postulat; Medan om banorna är kurvor (b.), bevis på att det finns interaktioner som inte kan ignoreras bland partiklarna.
Gasformiga partiklar är alltid i rörelse
Från de två första postulaten konvergerar dessutom att gaspartiklar aldrig slutar röra sig. När de väl är suddiga i behållaren kolliderar de med varandra och med väggarna på samma, med en kraft och hastighet direkt proportionell mot den absoluta temperaturen; Denna kraft är trycket.
Om de gasformiga partiklarna slutar röra sig runt ett ögonblick, skulle det bevittnas inuti "rökspråk", som härrör från ingenting, med tillräckligt med tid att beställa sig i ett vakuum och ge slumpmässiga sätt.
Kollisionerna mellan partiklarna och väggarna i behållaren är elastiska
Om de elastiska kollisionerna mellan gasformiga partiklar och väggarna i behållaren aldrig kommer att inträffa i behållaren, kommer den aldrig att inträffa (medan de fysiska förhållandena inte förändras) kondensationen av gasen; eller vad är detsamma som att säga att de aldrig vilar och att de alltid kolliderar.
Detta beror på att i elastiska kollisioner inte finns någon nettoförlust av kinetisk energi; En partikel kolliderar med väggen och studsar med samma hastighet. Om en partikel när kollisionen minskar hastigheten, accelererar den andra, utan värme eller ljud som sprider den kinetiska energin hos någon av dem.
Kinetisk energi förblir inte konstant
Partiklarnas rörelse är slumpmässig och kaotisk, så att inte alla har samma hastighet; Som händer, till exempel på en motorväg eller i en folkmassa. Vissa är mer energiska och reser mer hastighet, medan andra är långsamma och väntar på en kollision för att påskynda dem.
För att beskriva din hastighet är det då nödvändigt att beräkna ett genomsnitt; Och med detta erhålls den genomsnittliga kinetiska energin hos partiklar eller gasmolekyler. Eftersom den kinetiska energin hos alla partiklar ständigt förändras tillåter genomsnittet bättre datakontroll och du kan arbeta med större tillförlitlighet.
Genomsnittlig kinetisk energi är lika med en given temperatur för alla gaser
Genomsnittlig molekylär kinetisk energi (ECMord) I en behållare modifieras den med temperaturen. Vid en högre temperatur kommer denna energi att bli större. Eftersom det är ett genomsnitt kan det finnas partiklar eller läsk som har större eller mindre energi med avseende på detta värde; Vissa snabbare respektive långsammare.
Kan tjäna dig: syror och baser: skillnader, egenskaper, exempelMatematiskt kan det demonstreras att ECMord Det beror uteslutande på temperaturen. Detta betyder att det inte spelar någon roll vad gasen, dess molekylmassa eller struktur, dess EGMord Det kommer att vara detsamma vid en T -temperatur och kommer bara att variera om det ökar eller minskar. Av alla postulater kanske detta är det mest relevanta.
Och hur är det med den genomsnittliga molekylära hastigheten? Till skillnad från ECMord, Molekylmassa påverkar hastigheten. Ju tyngre partikel- eller gasmolekylen är det naturligt att förvänta sig att röra sig långsammare.
Exempel
Nedan följer några korta exempel på hur TCM har lyckats ge förklaringar till lagarna om idealiska gaser. Även om de inte behandlas kan andra fenomen, såsom spridning och utflöde av gaser, också förklaras med TCM.
Boyle Law
Om behållarens volym komprimeras vid konstant temperatur, minskar avståndet som de gasformiga partiklarna måste kollidera för att kollidera mot väggarna; vilket är lika med en ökning av frekvensen för dessa kollisioner, vilket resulterar i större tryck. När temperaturen är konstant, ECMord Det är också konstant.
Charles Law
Om t ökar ECMord kommer att öka. Gaspartiklar kommer att röra sig snabbare och kollidera ett större antal gånger med containerens väggar; ökar trycket.
Om väggarna är flexibla, kapabla att expandera, kommer dess område att bli större och trycket kommer att falla tills det blir konstant; Och som ett resultat kommer volymen också att öka.
Daltons lag
Om flera liter olika gaser tillsattes i en rymlig behållare, från mindre behållare, skulle deras totala inre tryck vara lika med summan av det partiella tryck som utövas av varje typ av gas separat.
Därför att? Eftersom alla gaser börjar kollidera med varandra och sprids homogent; Interaktioner mellan dem är ogiltiga, och vakuumet dominerar i behållaren (postulat av TCM), så det är som om varje gas finns ensam och utövar sitt tryck på ett individuellt sätt utan störningar av de andra gaserna.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning, s 426-431.
- Fernández pablo. (2019). Molekylär kinetisk teori. Vix. Återhämtat sig från: vix.com
- Jones, Andrew Zimmerman. (7 februari 2019). Kinetisk molekylär teori om gaser. Återhämtat sig från: tankco.com
- Hall Nancy. (5 maj 2015). Kinetisk teori om gaser. Glenn Research Center. Hämtad från: GRC.pott.Gov
- BABER M. & Lägre S. (9 oktober 2018). Grunderna i kinetisk molekylär teori. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Den kinetiska molekylära teorin. Hämtad från: Chemed.Kem.Purdu.Edu
- Wikipedia. (2019). Kinetisk teori om gaser. Hämtad från: i.Wikipedia.org
- Toppr. (s.F.). Kinetisk molekylär teori om gaser. Återhämtat sig från: toppr.com

