Sea Theory of Electrons Fundamentals and Properties
- 2496
- 357
- PhD. Emil Svensson
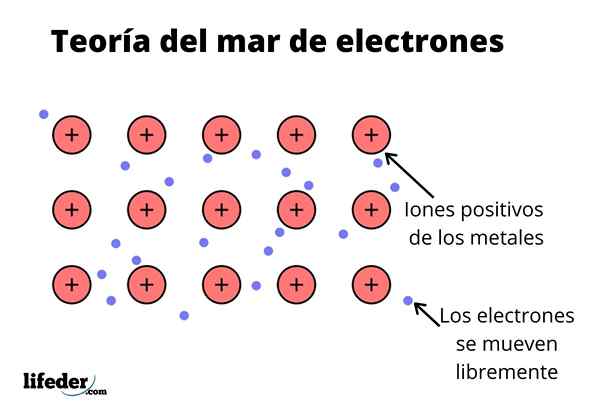
De Elektronhavssteori Det är en hypotes som förklarar ett exceptionellt kemiskt fenomen som förekommer i metallbindningar mellan element med låga elektronegativiteter. Detta är delningen av elektroner mellan olika förenade atomer genom metallbindningar.
Den elektroniska densiteten mellan dessa bindningar är sådan att elektronerna flyttas och bildar ett "hav" där de rör sig fritt. Det kan också uttryckas med kvantmekanik: vissa elektroner (det finns vanligtvis en till sju per atom) är ordnade i orbitaler med flera centra som sträckas av den metalliska ytan.
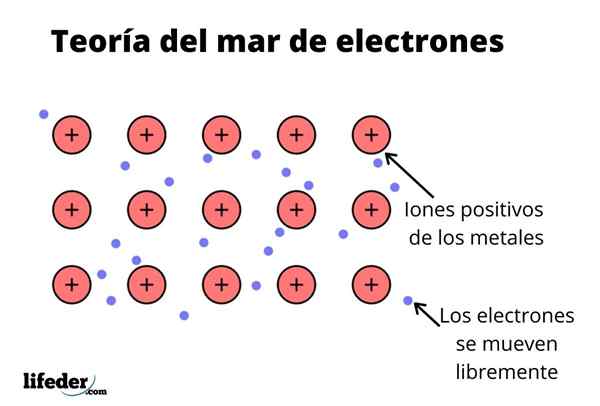
Elektroner behåller också någon plats i metall, även om sannolikhetsfördelningen för det elektroniska molnet har större densitet runt vissa specifika atomer. Detta beror på att när en specifik ström appliceras, manifesterar de sin konduktivitet i en specifik riktning.
[TOC]
Grundläggande i elektronhavssteori
Metallelement har en stor tendens att donera elektroner av sin senaste energinivå (valensskikt) på grund av deras låga joniseringsenergi i förhållande till de andra elementen.
Genom att veta detta kan varje metalliskt element betraktas som en katjon kopplad till elektronen på sin sista energinivå, vilket skulle vara mer benäget att donera.
Liksom i en metall finns ett stort antal atomer som är kopplade till varandra, kan antas att denna metall bildar en grupp metallkationer som kastas in i ett slags hav av valenselektroner som har stor omlokalisering.
Med tanke på att de elektrostatiska attraktionskrafterna mellan katjonen (positiv belastning) och elektronen (negativ belastning) har atomerna i metallen kopplade starkt, föreställ dig att omlokaliseringen av valenselektronerna uppträder som ett elektrostatiskt lim som behåller kopplade till metallkationer.
Kan tjäna dig: polymererPå detta sätt kan man dra slutsatsen att ju större antalet elektroner som finns i Valencia -skiktet av en metall, denna typ av elektrostatisk lim kommer att ha en större styrka.
Egenskaper
Elektronhavssteorin erbjuder en enkel förklaring till egenskaperna hos metallarter som motstånd, konduktivitet, duktilitet och formbarhet, som varierar från en metall till en annan.
Det har upptäckts att motståndet som tilldelats metaller beror på den stora omlokaliseringen av deras elektroner, som genererar en mycket hög sammanhållningskraft mellan atomerna som bildar den.
På detta sätt är duktilitet känd som förmågan hos vissa material att tillåta deformation av deras struktur, utan att ge tillräckligt för att bryta, när de utsätts för vissa krafter.
Delokalisering i form av lager
Både duktiliteten och formbarheten hos en metall bestäms av det faktum att Valencia -elektroner demokeras i alla riktningar i form av lager, vilket gör att de förskjuter varandra innan en yttre kraft, undviker nedbrytningen av metallstrukturen men tillåter att tillåta metallstrukturen men tillåter dess deformation.
På samma sätt tillåter friheten för rörelse av flyttade elektroner ett flöde av elektrisk ström, vilket gör att metaller kan ha mycket god elektricitetskonduktivitet.
Dessutom tillåter detta fenomen med fri rörlighet för elektroner överföring av kinetisk energi mellan de olika metallregionerna, vilket främjar värmeöverföring och gör metaller manifestera en stor värmeledningsförmåga.
Det kan tjäna dig: jodosyra (HiO2): egenskaper och användningarElektroner Seori i metallkristaller
Kristaller är fasta ämnen som har fysiska och kemiska egenskaper - som densitet, smältning och hårdhetspunkt - som är etablerade av den typ av krafter som gör att partiklarna som omfattar dem hålls ihop.
På ett sätt anses det att metalliska kristaller har de enklaste strukturerna, eftersom varje "punkt" i glasnätet har ockuperats av en atom av själva metallen.
I samma mening har det fastställts att strukturen för metallkristaller i allmänhet är kubisk och fokuserar på ansikten eller kroppen.
Dessa arter kan emellertid också ha en hexagonal form och ha en ganska kompakt förpackning, vilket ger dem den enorm densitet som är karakteristisk för dem.
På grund av detta strukturella skäl skiljer sig länkarna som bildas i metallkristaller från de som förekommer i andra kristallklasser. Under hela den kristallina strukturen förklaras elektroner som kan bilda bindningar, som förklarats ovan, tidigare.

Nackdelar med teorin
I metallatomer finns det en liten mängd valenselektroner i proportion till deras energinivåer; Det vill säga, det finns en större mängd energitillstånd tillgängliga än mängden länkade elektroner.
Detta innebär att, eftersom det finns en stark elektronisk omlokalisering och även energiband som delvis har fyllts, kan elektroner röra sig genom retikulära strukturen när de utsätts för ett elektriskt fält från utlandet, förutom att bilda elektronhavet som medger permeabiliteten hos nätverket.
Kan tjäna dig: OxácidoSå föreningen av metaller tolkas som ett konglomerat av positiva joner kopplat av ett hav av elektroner (negativ belastning).
Det finns emellertid egenskaper som inte förklaras genom denna modell, till exempel bildandet av vissa legeringar mellan metaller med specifika kompositioner eller stabiliteten hos kollektiva metalllänkar, bland andra.
Dessa besvär förklaras av kvantmekanik, eftersom både denna teori och många andra tillvägagångssätt har fastställts baserat på den enklaste modellen för en enda elektron, medan de försöker tillämpa i mycket mer komplexa strukturer av multielektroniska atomer.
Referenser
- Wikipedia. (2018). Wikipedia. Hämtas från.Wikipedia.org
- Holman, J. S., Och sten, s. (2001). Kemi. Återhämtat sig från böcker.Google.co.gå
- Parkin, g. (2010). Metallmetallbindning. Återhämtat sig från böcker.Google.co.gå
- Rohrer, g. S. (2001). Struktur och bindning i kristallina material. Återhämtat sig från böcker.Google.co.gå
- Ibach, h., och Lüth, h. (2009). Solid-state-fysik: En introduktion till principer för materialvetenskap. Återhämtat sig från böcker.Google.co.gå

