Tioles
- 3377
- 731
- Johan Olsson
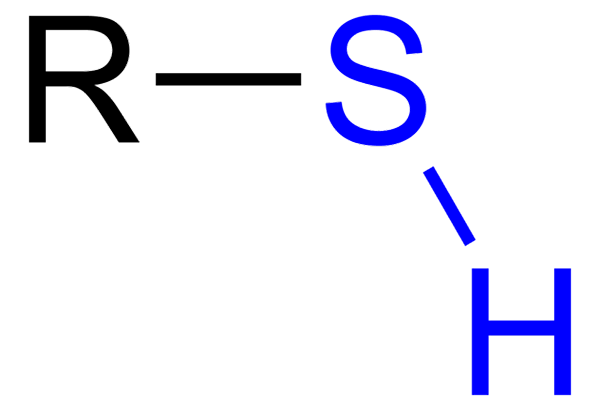
De Tioles De är organiska föreningar som har en SH -grupp, kallad tiol eller sulfihydrilo -grupp. Dess allmänna formel är RSH, att kunna representera R till en hyra, en aryl eller annan kemisk grupp. Tiolesnas utmärkande kännetecken är dess starka stinkande lukt.
Vissa tioler används för att förmedla sin lukt av brännbara gaser för att upptäcka ett läckage av dessa gaser, vilket med tanke på deras egenskap kan vara av stor fara. Tioler liknar alkoholer, eftersom de har en OH -grupp, medan tiolerna är en sh.
 Tiol med blå sulfhydrillo -grupp
Tiol med blå sulfhydrillo -grupp Men de har i sin tur flera skillnader: OH -gruppen är mer polär än SH -gruppen, och svavel är en mindre atom än syre och mindre elektronegativ.
Detta bestämmer att tiolesmolekyler inte bildar vätebindningar eller vatten eller bland dem. Därför är lösligheten för tioles i vattnet låg och dess kokpunkt är lägre än alkoholer med en kedja av liknande kolhydrater.
Tioler är särskilt användbara och ofta i biokemiska system, eftersom flera motsvarar biomolekyler, såsom koenzym till. S-H-bindningen är surare än O-H, lättare att bryta, och också lättare att ersätta eller ersätta andra molekylfragment i många svavelorganiska syntes.
[TOC]
Tioles -egenskaper
 Den illaluktande doften av foten består främst av tioler
Den illaluktande doften av foten består främst av tioler Generaliteter
OH -gruppen av alkoholer och SH -gruppen av tiolerna delar en uppsättning fysiska och kemiska egenskaper för tillhörande syre och svavel till samma kemiska grupp av den periodiska tabellen (via grupp).
Loa tioéter, uniocetals och tioésters, som är analoga med kemiska föreningar bildade av alkoholer, såsom etrar, acetaler och estrar. S-H- och O-H-länkar presenterar emellertid vissa skillnader som kommer att återspeglas i egenskaperna hos tioles och alkoholer.
Lukt
Ett kännetecken för tioles med låg molekylvikt är dess obehagliga lukt, liknande vitlök och lök. Denna lukt är av en sådan storlek att den mänskliga lukten har en tröskel för en del av tiolet för tio miljarder delar av luften.
Etanotiol tillsätts till naturgas som en säkerhetsåtgärd, för att upptäcka alla brandfarliga men toalettflykt sig själv. Lukten av tioler minskar genom att öka antalet kolkolor, eftersom volatiliteten och andelen tiolsvavel minskar.
Kan tjäna dig: ammoniumfosfat: struktur, egenskaper, erhållning, användningKokpunkt och löslighet
S-H-länken för tioles har ett dipolmoment mindre än O-H-länken till alkoholerna. Dessutom är svavelatomen mindre och mindre elektronegativitet än syreatomen.
Detta fastställer att tiolesmolekyler inte kan bilda vätebindningar med vatten eller bland dem, vilket orsakar en skillnad mellan de fysiska egenskaperna hos tioer och alkoholer. Till exempel: Metanotiol (Cho3Sh) har en kokpunkt på 6 ºC, medan metanol (CHO3OH) kokar vid 65 ° C.
Därför är metanol vid rumstemperatur (25 ° C) en vätska och metanotiol är en gas.
Sammanfattningsvis: Tioler har en lägre kokpunkt än motsvarande alkoholer som presenteras. Av samma skäl är lösligheten för tioles i vattnet och i andra polära lösningsmedel mycket låg. Samtidigt är alkoholer med låg molekylvikt mycket lösliga i vatten.
Reaktivitet
S-H-länken är svagare än O-H-bindningen, så länk S-H dissocierar lättare, vilket gör tioler starka syror än alkoholer. De flesta alkoholer har en PKA mellan 16 och 18 år, medan tioler har en PKA cirka 11.
Detta tillåter tioler-): Ett mycket starkt nukleofilt medel.
SH-gruppen kan oxidera för att bilda disulfider-länkar (-s-S-) som finns i glutationisk oxidation: en tiol som finns i celler och har en antioxidantfunktion.
Bromo eller andra halogener såväl som syre kan agera på en tiol för att bilda disulfurbroar:
2 RSH +BR → R-S-S-R '+2 HBR
RSSR 'föreningar är kända som organiska sulfider och alkiiler, R2S.
Å andra sidan kan starka oxiderande medel, såsom natriumhypoklorit och väteperoxid, verka på tioler för att orsaka sulfonsyror:
Rsh +h2ANTINGEN2 → RSO3H +3 h2ANTINGEN
Nomenklatur
IUPAC -nomenklaturen för thioles är mycket lik den hos alkoholer: namnet på alkano från vilken suffixet 'tiol' läggs till honom.
Således kallas den stano-härledda tistan 1-butanotiol, ch3Ch2Ch2Ch2Sh, indikerar med numret SH -gruppens position i kedjan i kedjan.
Kan tjäna dig: katjon: träning, skillnader med anjon och exempelPå samma sätt finns det en annan nomenklatur, återigen, liknande den för alkoholer: ordet "alkohol" ersätts av "merkaptan" i namnen på alkoholer. Till exempel Cho3SH, analog till metylalkohol, CH3Åh, kallas metyl eller merkaptan merkaptan.
Ett annat exempel skulle vara Cho3Ch2Ch (sh) ch3, Kallas 2-butanotiol, sekbutilisk köpman eller varor. Det vill säga, betoning läggs på RSH -formelns identitet. Följaktligen uppfylls också de andra nomenklaturerna för alkoholer för tioler.
Och slutligen, när SH -gruppen är närvarande i en större struktur eller där de viktigaste grupperna dominerar, används sulfihydrilo eller merkapto -prefixet.
Till exempel sammansatt ch3Ch2Ch (sh) coch3 Det kallas 3-Mercapto-2-Penona. Observera att SH har mindre prioritet än syresatta grupper (med undantag för etern), så mindre siffror motsvarar den.
Syntes
En metod för syntes av tioles består av reaktionen av tiota med en alkylhalogenid, som producerar ett mellanliggande salt av isotiouron. Detta hydrolyseras av natriumhydroxid för att få tiol och urea.
Ch3SH framställs industriellt genom reaktion av vätesulfid med metanol, i närvaro av syrakatalysatorer:
Ch3Oh +h2S → ch3Sh +h2ANTINGEN
I en annan produktionsmetod reageras en alkylhalogenid med natriumhydrosulfuro:
Rx +nash → rsh +nax
Ansökningar
Enzymfixering kopplad till nanopartiklar
Tioler används som broar för att ansluta sig till nanoparticula-enzymkomplex till guldelektroder. Till exempel används tioler för fixering av nanopartikel-uricasa-komplexet, ett enzym som ingriper i omvandlingen av urinsyra till allantoin.
Tiol -ingen reaktion
Det är en organisk reaktion mellan en tiol och en alken som kallar en "klick" -reaktion; Att det bland andra egenskaper är en högpresterande reaktion, bred omfattning, som skapar eliminerbart med -produkter med icke -kromatografiska metoder, och det är också lätt att utföra.
Tiol -ingen reaktion har tillämpningar i syntesen av tioazúcar: socker närvarande i salicinol, en a -glykosidasinhibitor. Salicinol har isolerats från växter som används på Sri Lanka och Indien vid behandling av diabetes.
Dessutom används tiol -ingen reaktion i kemin för kolhydrater, polymerisationer, ytkemi, synteskemi och kemi för peptider.
Kan tjäna dig: Fryspunkt: Hur man beräknar den och exempelLuktmedel
 Köksgasen är toalett, men tack vare sin sammansättning av tiolekyler med låg molekylvikt har den en distinkt lukt
Köksgasen är toalett, men tack vare sin sammansättning av tiolekyler med låg molekylvikt har den en distinkt lukt Alifatiska tioler med låg molekylvikt införlivas i naturgaser så att deras starka lukt fungerar som en varning inför en flykt eller läckage av gas.
Medicin
Penicilamin (c5HelvaNEJ2S) Det är ett läkemedel som används vid behandling av Wilsons sjukdom och reumatoid artrit.
Och Captopril (C9HfemtonNEJ3S), å andra sidan används det vid behandling av arteriell hypertoni och vid kongestiv hjärtsjukdom.
Båda är exempel på tioler med medicinska tillämpningar.
Biologisk
Tioles -grupper är närvarande, bland andra föreningar med biologisk funktion, i cystein, koenzym A och glutation.
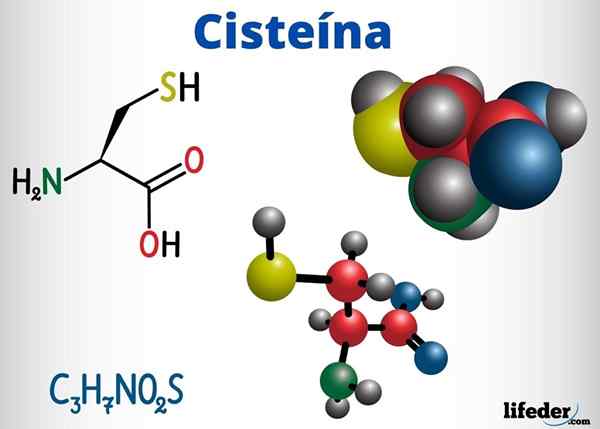
Cystein är en aminosyran som kan bilda disulfurbroar i sin proteinkedja, därför ansvarig för den tertiära strukturen hos ett protein. Det kan också bilda disulfurbroar mellan olika proteinkedjor, vilket orsakar den kvartära strukturen hos proteiner.
Cystein ligger i de aktiva centra för många enzymer och har också en antioxidantverkan.
Glutation är en mycket viktig antioxidant intracellulär verkan, vilket ger skydd till celler och makromolekyler som komponerar det.
Koenzym A är å andra sidan en tiol som ingriper i syntesen och oxidationen av fettsyror. Dessutom ingriper koenzym under form av acetylcoenzym A, i början av citronsyran eller Krebs -cykeln.
Exempel
Slutligen kommer vissa namn på tioles att listas åtföljas av deras molekylformler:
-Tioättiksyra (c2H4DU)
-Koenzym A (CtjugoettH36N7ANTINGEN16P3S)
-Minskad glutation (c10H17N3ANTINGEN6S)
-Cystein (c3H7NEJ2S)
-Mercaptanol (c2H6DU)
-Metanotiol (ch3Sh)
-1-propanotiol (c3H7Sh)
-Butanotiol (c4H 9Sh)
-Tiofenol eller tiomerosal (c6H6S)
-Pomelo merkaptano (c10H18S)
-Hexadecanotiol (c6H3. 4S)
-Penicillamin (c6HelvaNEJ2S)
-Captopril (c9HfemtonNEJ3S)
-Etanotiol (c2H6S)
-2-propenetiol (c3H6S)
-A-lipoic eller lipoamid (C8H14ANTINGEN2S2). Det är en cyklisk disulfid.
Referenser
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. (10th Utgåva.). Wiley Plus.
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Morrison och Boyd. (1987). Organisk kemi. (Femte upplagan). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Tiol. Hämtad från: i.Wikipedia.org
- Doktor. Dietmar Kennepohl et al. (13 september 2020). Tioler och sulfider. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Redaktörerna för Enyclopaedia Britannica. (2020). Tiol. Återhämtat sig från: Britannica.com
- Nolan MD och Scanlan EM (2020) Tillämpningar av tiol-en kemi för peptidvetenskap. Främre. Kem. 8: 583272. Doi: 10.3389/FCHEM.2020.583272
- Doktor. Carl c. Wamser. (1999). Kapitel 9: Alkoholer och tioler. Hämtad från: webben.Pdx.Edu

