Tyrosinegenskaper, struktur, funktioner, fördelar
- 3832
- 352
- Hans Olsson
De Tyrosin (Tyr, Y) är en av de 22 aminosyrorna som utgör proteinerna från alla celler som finns i levande varelser. Till skillnad från andra aminosyror som valin, Treonine, Tryptophan, Leucine, Lysine och andra, är tyrosin en "villkorligt" väsentligen väsentlig aminosyra.
Namnet "Tyrosin" härstammar från det grekiska ordet "skytte", Vilket betyder ost, eftersom denna aminosyra först upptäcktes i denna mat. Termen myntades 1846 av Liebig, som blandade ost med kaliumhydroxid och erhöll en okänd förening, knappast löslig i vatten.
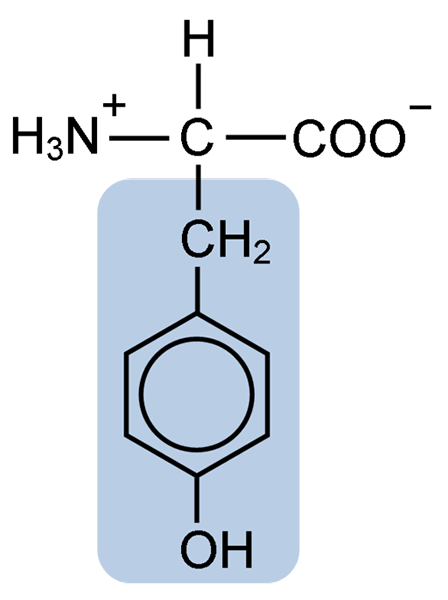
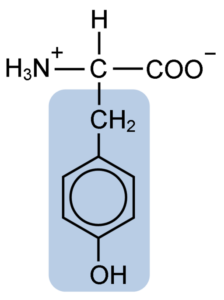 Kemisk struktur av tyrosinaminosyran (källa: Clavecin [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] via Wikimedia Commons)
Kemisk struktur av tyrosinaminosyran (källa: Clavecin [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] via Wikimedia Commons) Efter den första beskrivningen erhölls andra forskare som Warren de La Rue och Hinterberger från Cocoid Insects respektive Horns -proteiner. Dess separering från hydrolysen av andra proteiner med saltsyra beskrevs 1901 av Mörner.
Generellt erhålls denna aminosyran hos däggdjur tack vare hydroxylering av fenylalanin, även om den också absorberas i tarmen från proteinerna som konsumeras med mat.
Tyrosin har flera funktioner i människokroppen och bland dessa är de mest relevanta kanske det för substrat för produktion av neurotransmittorer och hormoner som adrenalin och sköldkörtelhormon.
[TOC]
Egenskaper
Tyrosin väger cirka 180 g/mol och dess R- eller sidokedjegrupp har en 10 -dissociationskonstant 10.07. Dess relativa överflöd i cellproteiner överstiger inte 4%, men har flera väsentliga funktioner för mänsklig fysiologi.
Denna aminosyra tillhör gruppen av aromatiska aminosyror, där fenylalanin och tryptofan också är. Medlemmarna i denna grupp har aromatiska ringar i sina r- eller sidokedjor och vanligtvis är de hydrofoba eller apolära aminosyror.
Liksom tryptofan absorberar tyrosin ultraviolett ljus och är ett av aminosyravfallet som ansvarar för absorbansen av ljus till 280 nm av många proteiner, så det är användbart för dess karaktärisering.
Det anses vara en väsentlig "villkorligt" aminosyra eftersom dess biosyntes hos människan beror på fenylalanin, en essentiell aminosyra. Om kroppen uppfyller dess dagliga krav på fenylalanin kan tyrosin syntetiseras utan problem och inte är en begränsande aminosyra.
Men om dieten saknas i fenylalanin kommer kroppen inte bara att ha en obalans av denna aminosyra, utan också av tyrosin. Det är också viktigt att påpeka att reaktionen av tyrosinsyntes från fenylalanin inte är reversibel, så tyrosinen kan inte tillgodose fenylalaninens cellulära behov.
Tyrosin tillhör också aminosyragruppen med dubbla funktioner i produktionen av glukogena och ketogena metaboliska mellanhänder, som deltar i syntesen av glukos för hjärnan och i bildningen av ketonkroppar i levern.
Strukturera
Liksom resten av aminosyrorna, tyrosinen eller p-parahydroxifenyl-a-aminosyra är det en a-aminosyra som har en central kolatom, kallad kol a och som är chiral, eftersom den är kopplad till fyra olika substituentatomer eller molekyler.
Detta quirala kol är kopplat till två karakteristiska grupper av aminosyror: en aminogrupp (NH2) och en karboxylgrupp (COOH). Han delar också en av sina bindningar med en väteatom och den återstående bindningen ockuperas av R- eller sidokedjan för varje aminosyra.
När det gäller tyrosin består denna grupp av en aromatisk ring associerad med en hydroxylgrupp (OH), vilket ger den förmågan att bilda vätebroar med andra molekyler och som ger den väsentliga funktionella egenskaper för vissa enzymer.
Det kan tjäna dig: baroreceptorerFunktioner
Tyrosin är en grundläggande komponent i många proteiner med stor mångfald av biologiska aktiviteter och funktioner.
Hos människor och andra däggdjur utnyttjas denna aminosyra i nerv- och njurvävnader för syntes av dopamin, adrenalin och norepinefrin, tre neurotransmittorer relaterade katekolaminergika relaterade till yttersta betydelse för kroppsfunktion.
Det är också viktigt för syntesen av ultravioletta strålningsskydd (UV) såsom melanin; av vissa smärtstillande medel som endorfiner och antioxidantmolekyler såsom vitamin E.
På liknande sätt tjänar denna aminosyra för syntes av tiramin, bläckfisk- och sköldkörtelhormoner genom jodorganisation i tyrosinresten av tyoglobulin.
Tiramin är en vasoaktiv molekyl som finns i människokroppen och bläckfisk är en amin relaterad till noreprenalin.
Alla dessa funktioner av tyrosin är möjliga tack vare att det erhålls från proteinerna i dieten eller genom hydroxylering av fenylalanin med levern som huvudsystemet för systemtillförsel av nämnda aminosyra.
Funktioner i växter
Tyrosin och några av de mellanhänder som genererades under deras biosyntes matar de biosyntetiska vägarna för metaboliter som är specialiserade på försvar, i attraktionen av pollinatorer, i elektronisk transport och strukturellt stöd.
Biosyntes
Hos människan erhålls tyrosin från kosten eller syntetiseras i ett enda steg av leverceller från fenylalanin, en essentiell aminosyra, genom reaktionen katalyserad av fenylalaninhydroxylas enzymatiska komplexet.
Detta komplex har syresaktivitet och finns endast i levern av människor eller andra däggdjur. Tyrosinsyntesreaktion innebär då överföring av en syreatom till positionen för av den aromatiska ringen av fenylalanin.
Denna reaktion inträffar samtidigt som en vattenmolekyl bildas på grund av reduktionen av en annan molekylär syreatom och den reducerande kraften bidrar direkt av en NADPH -konjugerad med en tetrahydropterinmolekyl, som liknar folinsyra.
Biosyntes i växter
I växter syntetiseras tyrosin novo Nedströms om "shikimato" -vägen, som matar andra biosyntetiska rutter av andra aromatiska aminosyror såsom fenylalanin och tryptofan.
I dessa organismer är syntesen baserad på en förening som kallas "Corismato", som är den slutliga produkten från Shikimato -rutten och dessutom den vanliga föregångaren för alla aromatiska aminosyror, vissa vitaminer och växthormoner.
Korismatet omvandlas till förord genom den katalytiska verkan av mutasa -korismatenzymet och detta är det första "engagerade" steget i syntesen av tyrosin och fenylalanin i växter.
Predeneaten omvandlas till tyrosin genom en oxidativ dekarboxylering och en transaminering, som kan uppstå i vilken ordning som helst.
I en av de biosyntetiska vägarna kan dessa steg katalyseras av specifika enzymer som kallas prefenatspecifikt dehydrogenas (PDH) (som omvandlar förordet till 4-hydroxyfenylpyrpyruvat (HPP)) och tyrosinaminotransferas (som producerar den hål från HiproSINE, HYPPYRE), respektive.
En annan väg för syntes av tyrosin från förordet innebär transaminering av predeneat till en icke-proteinogen aminosyra som kallas L-arogenat, katalyserad av enzymet preenate aminotransferase.
L-arogenatet undervisas därefter oxidativ dekarboxylering för att bilda tyroxin, en reaktion regisserad av en enzym-tyrosin-arogenatspecifikt dehydrogenas, även känd som ADH.
Växter använder företrädesvis arenans rutt, medan de flesta mikrober syntetiserar tyrosin från HPP härrörande från predenesatet.
Reglering
Som är sant för de flesta av de biosyntetiska vägarna för aminosyror, har växter ett strikt regleringssystem av syntesen av aromatiska aminosyror, inklusive tyrosin.
Kan tjäna dig: läckert monster: egenskaper, livsmiljö, vård, egenskaperI dessa organismer sker reglering på många nivåer, eftersom mekanismerna som styr Shikimato -rutten också kontrollerar produktionen av tyrosin, en rutt som det också finns deras egna regleringsmekanismer.
Tyrosinkraven och därför styvheten i regleringen av deras biosyntes är specifika för varje växtart.
Degradering
Nedbrytning eller katabolism av tyrosin resulterar i bildning av fumarat och acetoacetat. Det första steget i denna rutt består i omvandlingen av aminosyran till 4-hydroxifenylpypypat av ett cytosoliskt enzym som kallas aminotransferas-tyrosin.
Denna aminosyran kan också transamineras i mitokondrierna av hepatocyter genom en aminotransferasaspartatenzym, även om detta enzym inte är särskilt viktigt vid normala fysiologiska förhållanden.
Genom nedbrytning av tyrosin kan succinyl-acetoacetat uppstå, vilket kan dekarboxyleras till succinyl-acetat. Succinyl-acetat är den mest kraftfulla enzyminhibitorn som är ansvarig för syntesen av hemo-gruppen, 5-aminolevulinsyra-dehydratas.
Adrenalin och noradrenalinssyntes
Som nämnts är tyrosin ett av de viktigaste substraten för syntesen av två mycket viktiga neurotransmittorer för människokroppen: adrenalin och norepinefrin.
Detta används initialt av ett enzym som kallas hydroxylas -tyrosinen, som kan tillsätta en ytterligare hydroxylgrupp till den aromatiska ringen för Ri -tyrosin R -gruppen, som bildar föreningen känd som DOPA.
DOPA ger upphov till dopamin när den har enzymatiskt bearbetat av en enzym Dopa Decboxilas.
Dopamin omvandlas därefter till noreprenalin genom verkan av p -oxidasdopamin -enzymet, som katalyserar tillsatsen av en hydroxylgrupp till -ch som var en del av gruppen R av tyrosinen och som fungerade som en "bro" mellan den aromatiska ringen och kol a.
Adrenalin härstammar från norepinefrin genom verkan av fenytanolamin N-Metyltransferas, som är ansvarig för den S-adenosyl-minmetinberoende överföring av en metylgrupp (-CH3) till den fria aminogruppen av norepinefrin.
Livsmedel rika på tyrosin
Som nämnts ovan är tyrosin en väsentlig "villkorligt" aminosyra, eftersom den syntetiseras i människokroppen genom hydroxylering av fenylalanin, en essentiell aminosyra.
Därför, om intaget av fenylalanin täcker kroppskrav, är tyrosin inte en begränsande faktor för normal funktion av celler. Tyrosin förvärvas emellertid också från proteiner som konsumeras med dagliga livsmedel.
Vissa studier rapporterar att lägsta dagliga intag av både tyrosin och fenylalanin bör vara mellan 25 och 30 mg per kilo vikt, så en genomsnittlig person bör konsumera mer eller mindre 875 mg tyrosin per dag.
Mat med högre tyrosininnehåll är ost och sojabönor. Bland dessa är också nötkött, lamm, fläsk, kyckling och fisk.
Vissa frön och nötter som nötter ger också betydande bidrag från denna aminosyra, såväl som ägg, mejeriprodukter, korn och spannmål.
Fördelar med ditt intag
Tyrosin konsumeras vanligtvis i form av kost- eller näringstillskott, särskilt för behandling av patologi som kallas fenylcetonuri, som drabbats av patienter som inte kan bearbeta fenylalanin korrekt och därför inte producera tyrosin.
Det kan tjäna dig: relationsfunktionMan tror att en ökning av mängden tyrosin som konsumeras per dag kan förbättra kognitiva funktioner relaterade till lärande, minne och varningstillstånd under stressande förhållanden, eftersom dess katabolism är relaterad till syntesen av adrenalin och norepinenial neurotransmittorer.
Vissa människor tar tirosin -rika tabletter för att hålla sig vaken under dagen om de har tappat en betydande mängd sömntimmar.
Eftersom denna aminosyran deltar i bildningen av sköldkörtelhormon kan dess konsumtion ha positiva effekter på systemisk metabolisk reglering.
Brist
Albinism och alcaptonuria är två patologier relaterade till tyrosinmetabolism. Det första tillståndet är relaterat till defekt melaninsyntes från tyrosin och det andra har att göra med defekter i tyrosinnedbrytning.
Albinism kännetecknas av bristen på pigmentering i huden, det vill säga patienterna som lider av det har vitt hår och rosa hud, eftersom melanin är det pigment som ansvarar för att ge färg till dessa strukturer.
Denna patologi har att göra med en brist i det specifika tyrosinaset av melanocyter, som är ansvarig för att omvandla tyrosin till Dopa-kinon, en mellanhand i syntesen av melanin.
Symtomen på alcaptonuria är tydliga som en överdriven urinpigmentering (mörk) och sen utveckling artrit.
Andra metaboliska patologier
Dessutom finns det andra störningar relaterade till tyrosinmetabolism, bland vilka är:
- Ärftlig tyrosinemi av typ I: kännetecknad av progressiv levergeneration och njurdysfunktion
- Ärftlig tyrosinemi av typ II eller Richner-Hanhart-syndrom: vilket är uppenbart som en keratit och ampulära lesioner i handflatorna och sulorna på fötterna
- Typ III -tyrosinemi: som kan vara asymptomatisk eller närvarande som mentala förseningar
- "Hawkinsinuria": kännetecknas av metabolisk acidos i barndomen och oförmågan att blomstra i tillväxt
Det finns också andra medfödda defekter i metrosinmetabolismen som har att göra med brister i enzymerna som är ansvariga för deras nedbrytning, såsom hydroxylas -tyrosin, som ansvarar för det första steget i syntesen av dopamin från tyrosin.
Referenser
- Aders plimmer, r. (1908). Proteins kemiska konstitution. jag lämnade. London, Storbritannien: Longmans, Green och Co.
- Chakrapani, a., Gissen, s., & McKiernan, s. (2012). Störningar i tyrosinmetabolism. I Innödd metabolisk önskan: diagnos och behandling (PP. 265-276).
- Kretchmer, n., Levine, s., McNamara, h., & Barnett, h. (1956). Vissa aspekter av tyrosinmetabolism hos unga. Yo. Utvecklingen av tyrosinoxidationssystemet i mänsklig lever. Journal of Clinical Investigation, 35(10), 1089-1093.
- Du, b., Zannoni, V., Laster, L., & Seegmiller, E. (1958). Arten av defekten i tyrosinmetabolismen i Alkaptonuria. Journal of Biologic Chemistry, 230, 251-260.
- Murray, r., Bender, D., Botham, K., Kennelly, s., Rodwell, V., & Weil, s. (2009). Harpers illustrerade biokemi (28: e upplagan.). McGraw-Hill Medical.
- Nelson, D. L., & Cox, M. M. (2009). Lehninger principer för biokemi. Omega -utgåvor (5: e upplagan.).
- Schenck, c. TILL., & Maeda, h. TILL. (2018). Tyrosinbiosyntes, metabolism och katabolism i växter. Fytokemi, 149, 82-102.
- Slominski, a., Zmijewski, m. TILL., & Paweley, J. (2012). L-tyrosin och L-dihydroxifenylalanin som hormonliknande regulatorer av melanocytfunktioner. Pigmentcell- och melanomforskning, 25(1), 14-27.
- Van de, g. (2018). Hälsovård. Hämtad 16 september 2019 från www.Hälsosjukdom.com
- MD -webb. (n.d.). Hämtad 15 september 2019 från www.WebMD.com
- Whitbread, D. (2019). Min matdata. Hämtad 15 september 2019 från www.Myfooddata.com

