Typtofanegenskaper, struktur, funktioner, fördelar
- 1376
- 343
- Hans Olsson
han Tryptofan (TRP, W) är en aminosyra klassificerad inom gruppen av essentiella aminosyror, eftersom den mänskliga organismen inte kan syntetisera den och måste få den genom kosten.
Vissa livsmedel som mjölk och deras derivat, kött, ägg och vissa spannmål som quinoa och soja innehåller essentiella aminosyror och är därför en viktig källa till tryptofan.
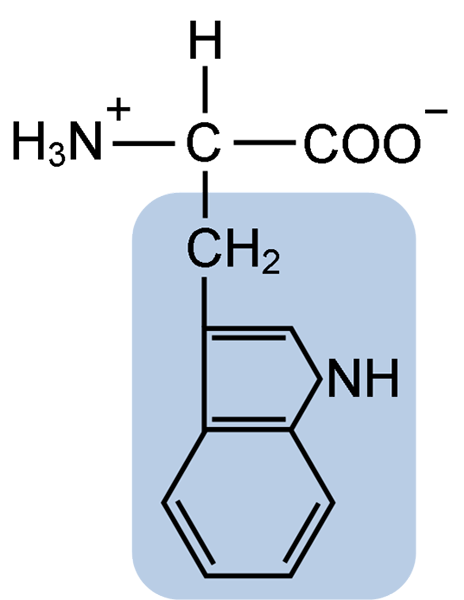
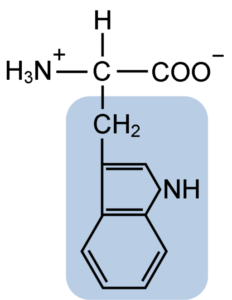 Kemisk struktur av typtofansaminosyran (källa: Clavecin [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] via Wikimedia Commons)
Kemisk struktur av typtofansaminosyran (källa: Clavecin [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] via Wikimedia Commons) I naturen är mer än 300 olika aminosyror kända och endast 22 utgör de monomera enheterna av cellproteiner. Bland de senare är 9 essentiella aminosyror, inklusive tryptofan, men väsentligheten av var och en skiljer sig mellan en art och en annan.
Tryptofanen har olika funktioner, bland vilka deras deltagande i proteinsyntes, i syntesen av serotonin, som är en kraftfull vasokonstriktor och neurotransmitter, av melatonin och i syntesen av co -forskaren Nad.
I växtriket är tryptofan en grundläggande föregångare för växthormonet som kallas auxin (indol-3-ättiksyra). Det kan syntetiseras av vissa bakterier som OCH. coli Från Corismato, som produceras från vissa glykolytiska derivat såsom fosfoenolpiruvat och erytrosa-4-fosfat.
Dess nedbrytning hos däggdjur förekommer i levern, där den används för syntes av acetylkoenzym A (acetyl-CoA), och av denna anledning beskrivs det som en aminosyran kallar glukogen, eftersom den kan komma in i glukosformationscykeln.
Olika studier har rapporterats med kontroversiella resultat relaterade till användning av tryptofan som ett kosttillskott för behandling av vissa patologier som depression och vissa sömnstörningar bland andra.
Det finns vissa sjukdomar relaterade till medfödda defekter i aminosyrametabolism. När det gäller Typtophan kan Hartnups sjukdom utses, på grund av tryptofan -2,3 -monoxigenas, en recessiv ärftlig sjukdom som kännetecknas av mental retaration och förändringar av hudtypens pelagra -typ.
[TOC]
Egenskaper
Tillsammans med fenylalanin och tyrosin finns tryptofan i gruppen av aromatiska och hydrofoba aminosyror.
Tryptofan kännetecknas emellertid av att vara en något hydrofob aminosyra sedan dess aromatiska sidokedja, genom att ha polära grupper, dämpar den hydrofobiciteten.
För att ha kombinerade ringar har de en stark absorption av ljus i spektrumområdet nära ultraviolett och denna egenskap används ofta för strukturell analys av proteiner.
Den absorberar ultraviolett ljus (mellan 250 och 290 nm) och även om denna aminosyran inte är särskilt rik i strukturen hos de flesta av de mänskliga kroppsproteinerna, representerar dess närvaro ett viktigt bidrag för ljusabsorptionskapaciteten i ljuset i området i regionen i det området 280 nm av de flesta proteiner.
Tryptofan dagliga krav skiljer sig åt med åldern. Hos spädbarn mellan 4 och 6 månader är det genomsnittliga kravet cirka 17 mg per kilo vikt per dag; Hos barn i åldern 10 till 12 är det 3,3 mg per kilo vikt per dag och hos vuxna är det 3,5 mg per kilo vikt per dag.
Tryptofan absorberas av tarmvägen och är en ketogen och glykogen aminosyra samtidigt.
Eftersom det är en serotoninföregångare, en viktig neurotransmitter, måste tryptofan nå centrala nervsystemet (CNS) och för detta måste den korsa blodhjärnbarriären, för vilken det finns en specifik aktiv transportmekanism.
Kan tjäna dig: Biggy Agar: Foundation, förberedelser och användningarStrukturera
Tryptophan har en molekylformel C11H12N2O2 och denna essentiella aminosyra har en aromatisk sidokedja.
Liksom alla aminosyror har tryptofan en a -kolatom fäst vid en aminogrupp (NH2), en väteatom (H), en karboxylgrupp (COOH) och en sidokedja (R) bildad av en heterocyklisk struktur, Indol -gruppen.
Dess kemiska namn är 2-amino-3-propionic syra, den har en molekylmassa på 204,23 g/mol. Dess löslighet vid 20 ° C är 1,06 g i 100 g vatten och har en densitet på 1,34 g/cm3.
Funktioner
Hos människan används tryptofanen för proteinsyntes och är nödvändig för serotoninbildning (5-hydroxitriptamin) En kraftfull vasokonstriktor, stimulering av den glatta muskelkontraktionen (särskilt i tunntarmen) och en neurotransmitter som kan generera psykisk stimulering, kombinerar depression som förpressionerar depression och reglera ångest.
Tryptophan är en föregångare i syntesen av melatonin och har därför konsekvenser i sömn och vaktcykler.
Nämnda aminosyran används som föregångare på ett av de tre sätten för bildandet av NAD-kofaktorn, en mycket viktig kofaktor som deltar i en mängd enzymatiska reaktioner relaterade till oxidreduktionshändelser.
Tryptophan och några av dess föregångare används för bildning av ett vegetationshormon som kallas auxin (Indol-3-aktiv syra). Auxiner är växthormoner som reglerar tillväxt, utveckling och många andra fysiologiska funktioner hos växter.
Biosyntes
I de organismer som kan syntetisera det härstammar tryptofans koldioxidskelett från fosfoenolpyruvat och erytrosa-4-fosfat. Dessa bildas i sin tur av en mellanhand av Krebs -cykeln: oxalacetat.
Fosfoenolpiruvat och erytrous-4-fosfat används för korismatsyntes på en sju enzymatisk väg. Fosfoenolpiruvate (PEP) är en produkt av glykolys och erytrous-4-fosfat av pentosfosfatvägen.
Hur är korismatens syntesväg?
Det första steget i symtomen på Corismato är föreningen av PEP med erytrosa-4-fosfat till form 2-ZO-3-Disoxxi-D-anabino-heptulosonato-7-fosfat (DAHP) (DAHP).
Denna reaktion katalyseras av enzymet 2-ZO-3-dexxi-D-anabino-heptulosonato-7-fosfatsyntas (DAHP-syntasa), som hämmas av korismatet.
Den andra reaktionen innebär ciklering av DAHP genom syntasdehydrokinat, ett enzym som kräver samfaktorn NAD, som reduceras under denna reaktion; Som ett resultat inträffar 5-diDroquinate.
Det tredje steget i denna rutt innebär eliminering av en vattenmolekyl av 5-dehydroquinat, reaktion katalyserad av enzymet dehydratasdehydrokinat, vars slutprodukt motsvarar 5-Dishydro-shikimato.
Keto -gruppen av denna molekyl reduceras till en hydroxylgrupp och som en följd av detta bildas Shikimato. Enzymet som katalyserar denna reaktion är NADPH-beroende beroende.
Det femte steget i rutten innebär bildning av 5-fosfat shikimate och konsumtionen av en ATP-molekyl av ett enzym som kallas kinas shikimato, ansvarig för fosforylering av shikimat i position 5.
Därefter, från 5-fosfat shikimate och genom verkan av 3-enlappiruvil shikimato-5-fosfatsyntas, genereras 3-enlappiruvil shikimato 5-fosfat. Det ovannämnda enzymet främjar förskjutningen av fosforylgruppen för en andra PEP-molekyl av hydroxylgruppen av kol i position 5 av 5-fosfat shikimate.
Det kan tjäna dig: Varför är det viktigt att ta hand om biologisk mångfald?Den sjunde och sista reaktionen katalyseras av syntaskorismen, som eliminerar fosfat från 3-Enlappate Shikimate 5-fosfat och gör det korismat.
I svampen N. Krassa, En enda multifunktionell enzymatisk komplex katalyserar fem av de sju reaktionerna på denna väg och detta komplex läggs till tre andra enzymer som slutar generera tryptofan.
Tryptofansyntes i bakterier
I OCH. coli, Tryptophan Corism Transformation inkluderar en ytterligare fem enzymatisk väg:
Först omvandlar antranilatsyntasenzymet korismatet till antranilat. I denna reaktion deltar en glutaminmolekyl, donerad av aminogruppen som binder till Indolringen av tryptofan och blir glutamat.
Det andra steget katalyseras av fosforbosyltransferasanranilatet. I denna reaktion rör sig en pyrofosfatmolekyl i 5-fosforibosyl-1-pyrofosfat (PRPP) (PRPP) rik på energi, och N- (5'-fosforibosyl) bildas.
Den tredje reaktionen av denna tryptofansyntesväg innebär deltagande av fosforbosyl-isomerasenzymet. Här n- (5'-phorribosyl) -Santranylat.
Senare bildas indol-3-glycerolfosfatet, i en reaktion som katalyseras av indol-3-glycerolsympati-syntasen, där en CO2 och en H2O-molekyl frigörs och 1- (O-karboxifenylamin) -1- Desoxyribulosa 5-fosfat.
Den sista reaktionen på denna rutt hamnar med att bilda tryptofan när tryptofansyntaskatalysen.
Degradering
Hos däggdjur nedbryts tryptofan i levern till acetyl-CoA på en rutt som involverar tolv enzymatiska steg: åtta att nå a-zo-stoadipat och 4 till för att konvertera a-zo-dotadipato till acetylkoenzym till.
Nedbrytningsordningen tills a-cetoadipato är:
Typtophan → N-Kinureninformil → kinurenin → 3-hydroxi kinurenin → 3-hydroxi-antranilat → ε-semialdehyd 2-amino-3-muconcycix mycket → ε-semialdehido α-amino muconic amouz.
De enzymer som katalyserar dessa reaktioner är:
Typtophan 2-3-dioxigenas, formamidas kinurenin, NADPH-beroende monooxigenas NADPH-beroende.
När a-cethoadipate genereras bildas oxidativ dekarboxylering gluteral-CoA. Detta genom ß-oxidation, glutakonyl-CoA-form som förlorar en bikarbonat kolatom (HCO3-), vinner en vattenmolekyl och slutar som crotonil-CoA.
Crotonil-CoA, även för ß-oxidation, ger acetyl-CoA. Nämnda acetyl-CoA kan följa flera sätt, bland vilka glukoneogenes, för att bilda glukos och Krebs-cykeln, för att bilda ATP, vid behov, vid behov.
Men denna molekyl kan också riktas mot bildandet av ketonkroppar, som äntligen kan användas som energikälla.
Livsmedel rika på tryptofan
Rött kött I allmänhet är kyckling och fisk (särskilt blå fisk som lax och tonfisk) särskilt rika på tryptofan. Mjölk och dess derivat, ägg, särskilt äggulan, är också livsmedel med massor av tryptofaninnehåll.
Andra livsmedel som fungerar som en naturlig källa till denna aminosyra är:
- Nötter som nötter, mandlar, pistascher och Anacardos, bland andra.
- Risflingor.
- Torra korn som bönor, linser, kikärter, sojabönor, quinoa, etc.
- Öljäst och färska bönor, bananer och bananer, ananas eller ananá, avokado, plommon, vattenkrasse, broccoli, spenat och choklad.
Det kan tjäna dig: ubåthaj: historia, verklighet eller fiktion?Fördelar med ditt intag
Typtofanförbrukning är absolut nödvändig för att syntetisera alla de proteiner som inkluderar den i dess struktur och genom dess olika funktioner tillåter det att reglera humör, sömn och vigilcykler och en mängd olika biokemiska processer där NAD deltar.
Förutom de kända effekterna på humör, serotonin (tryptofan härledd) i flera kognitiva funktioner relaterade till lärande och minne som därför också är relaterade till tryptofan.
Det finns data som visar förhållandet mellan humör, serotonin och gastrointestinal-cerebral axel som ett system med dubbelriktad påverkan mellan hjärnens emotionella och kognitiva centra och perifera funktion av matsmältningskanalen.
Användning som ett kosttillskott för behandling av vissa störningar, särskilt de som är relaterade till det centrala nervsystemet, har varit mycket kontroversiellt eftersom dess konkurrenstransport med neutrala aminosyror, mycket mer riklig, gör det svårt att uppnå betydande och hållbara ökningar i tryptofan efter dess muntliga administration.
Trots dessa kontroverser har dess användning postulerats som tillägg i:
- Smärtbehandling
- Sömnstörningar
- Depression behandling
- Manibehandling
- Aptitminskning
Brist
Den centrala elimineringen eller bristen på tryptofan åtföljs av depression, misslyckanden i uppmärksamhet, minskning i minne, sömn och ångeststörningar.
Hos deprimerade patienter och med självmordstrender har förändringar i koncentrationen av blod och cerebrospinalvätska hittats. Dessutom visar vissa patienter med nervös anorexi låga serumnivåer av tryptofan.
Vissa polyuriska patienter, som förlorar vitamin B6 och zink, har ofta fobier och ångest och förbättras med kosttillskott som är rika på triPophane.
Karcinoidsyndrom kännetecknas av närvaron av tunntarmstumörer som orsakar diarré, vaskulära sjukdomar och bronkokonstriktion och är relaterad till niacin- och tripofanunderskottet
Pelagra är ett patologiskt tillstånd som åtföljs av diarré, demens, dermatit och kan orsaka dödsfall, detta behandlas också med niacin och tryptofantillskott.
Hartnups sjukdom måste göra bland vissa saker med en defekt i ämnesomsättningen av flera aminosyror, inklusive tryptofan.
I fallet genom underskottet av typtofan -2,3-monoxigenasenzymet är detta en recessiv ärftlig sjukdom som kännetecknas av mental retardering och hudförändringar av hudtyp.
Referenser
- Halvorsen, k., & Halvorsen, s. (1963). Hartnup -sjukdom. Pediatrik, 31(1), 29-38.
- Huva, s. D., Bell, C. J., Argyropoulos, s. V., & Nutt, D. J. (2016). Don's Panic. En guide till tryptofanutarmning med störningsspecifik ångestprovokation. Journal of Psychopharmacology, 30(11), 1137-140.
- Jenkins, T. TILL., Nguyen, j. C., Polglaze, K. OCH., & Bertrand, s. P. (2016). Påverkan av tryptofan och serotonin på humör och kognition med en möjlig roll av tarmen-boinaxeln. Näringsämnen, 8(1), 56.
- Kaye, w. H., Barbarich, n. C., Putnam, k., Gendall, K. TILL., Fernström, J., Fernström, m.,... & Kishore, a. (2003). Angiolytiska effekter av akut tryptofanutarmning i anorexia nervosa. International Journal of Eating Disorders, 33(3), 257-267.
- Murray, r. K., Granner, D. K., Mayes, s., & Rodwell, V. (2009). Harpers illustrerade biokemi. 28 (p. 588). New York: McGraw-Hill.
- Nelson, D. L., Lehninger, a. L., & Cox, M. M. (2008). Lehninger principer för biokemi. Macmillan.

