Prolinegenskaper, struktur, funktioner, mat
- 4620
- 891
- Johan Gustafsson
De Prolin (Pro, P) tillhör de 22 aminosyrorna som klassificeras som grundläggande. Det är en icke -essentiell aminosyra, eftersom den kan syntetiseras av man och andra däggdjursdjur.
1900 var den tyska forskaren Richard Willstatter den första som extraherade och observerade prolinen. Det var emellertid Emili Fischer 1901 som myntade termen "prolin" baserat på pyrrolidinringen i aminosyran; Denna forskare lyckades också förklara i detalj syntesen av prolin från mjölkkaseinet.
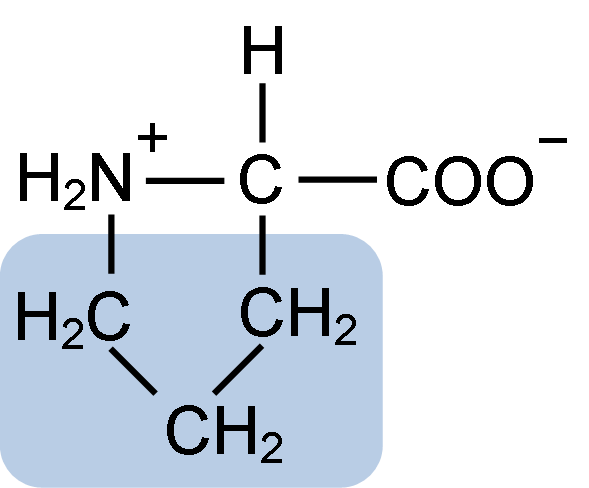
 Kemisk struktur av prolinaminosyran (källa: Clavecin [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] via Wikimedia Commons)
Kemisk struktur av prolinaminosyran (källa: Clavecin [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] via Wikimedia Commons) I proteiner som kasein har prolin en oumbärlig funktion i "svängar" och strukturell vikning. I detta protein distribueras prolinen homogent genom strukturen och kopplar till p -kaseinet och aS1 -proteinet; Dessutom förhindrar det defekta strukturella slingor eller vikning.
I de biokemiska analyserna som används för närvarande för att bestämma den exakta sekvensen av aminosyror som utgör proteinerna är prolinen en av de svåraste detektionsminosyrorna, eftersom den sekundära aminogruppen av prolinen har ett annat beteende och inte lätt upptäcks.
Skurv är kanske den mest kända sjukdomen relaterad till prolin. Det har att göra med en brist i C -vitaminintag, vilket direkt påverkar hydroxyleringen av prolin i kollagenfibrerna, vilket orsakar systemisk försvagning på grund av instabiliteten hos kollagenfibrerna som finns i hela kroppen.
[TOC]
Egenskaper
Den koldioxidbundna sekundära aminogruppen α gör Proline Classification -uppgiften något svår. I vissa texter klassificeras emellertid bredvid de grenade aminosyrorna eller med alifatiska sidokedjor, eftersom sidokedjan eller r -prolinen är hydrofob eller alifatisk.
En av de viktigaste egenskaperna hos prolinen är att vätebroarnas form, vilket gör det idealiskt att strukturera komplexa och komplicerade svängar i de tertiära strukturerna hos proteiner.
Precis som alla aminosyror har två isoformer som beror på den centrala kolatomen, kan prolinen hittas i naturen såsom L-prolin eller som D-prolol. Form L-Prolina är emellertid den vanligaste i naturen och är den som är en del av proteinstrukturerna.
I proteinerna där den ligger upptar prolinen ofta platser nära ytan eller vikningen eller "vändningen" på polypeptidkedjan, eftersom den styva och stängda strukturen i prolin gör en stark interaktion med annan aminosyran interaktion svår.
Strukturera
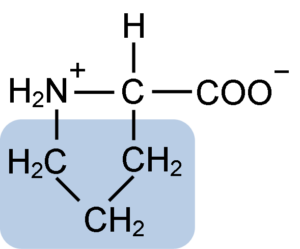
Prolinen har en viss struktur mellan grundläggande aminosyror, eftersom den presenterar en aminogrupp (NH2) sekundär och inte den primära aminogruppen som är karakteristisk för alla aminosyror.
Grupp R eller den laterala kedjan av prolin är en pyrrolidin eller tetrahydropirrolring. Denna grupp bildas av en heterocyklisk amin (inga dubbelbindningar) av fem kolatomer, där var och en av dessa är mättade med väteatomer.
Prolinen har den egenhet att den "centrala" kolatomen ingår i den heterocykliska pyrolidinringen, så den enda "fria" eller "enastående" atomerna är karboxylgruppen (COOH) och väteatomen (h) för den heterocykliska ringen av aminosyran.
Kan tjäna dig: Superoxide dysmutas: egenskaper, struktur, funktionerProlinens molekylformel är C5H9NO2 och dess IUPAC-namn är pirrolidin-2-karboxylsyra. Den har en ungefärlig molekylvikt på 115,13 g/mol och dess frekvens av utseende i proteiner är cirka 7%.
Funktioner
Kollagen- och tropokollagenfibrer är de vanligaste proteinerna hos de flesta ryggradsdjur. Dessa utgör huden, senorna, benmatrisen och många andra vävnader.
Kollagenfibrer består av många trippelpolypeptidutlösare som i sin tur består av flera prolin- och glycinrester i glycin-praktolin-prolin/hydroxiprololinsekvensen (den senare är ett modifierat derivat av prolinen).
I sin ursprungliga form är prolinen en del av procollagen, detta är en föregångare till kollagens polypeptider och några andra proteiner i bindvävnaden. Enzymet prolinhydroxylas.
Vad är prolinens huvudfunktion i kollagenfibrerna?
Hydroxiprolin ger kollagenresistensegenskaper, eftersom detta aminosyrorivat har förmågan att bilda ett stort antal vätebroar mellan trippelpropellerkedjorna som utgör proteinet.
De enzymer som katalyserar hydroxyleringen av prolinavfall kräver närvaro av vitamin C (askorbinsyra) och, som nämnts ovan, beror skörningen på försvagningen av kollagenfibrer på grund av misslyckanden i hydroxylering av prolinavfall, vilket orsakar en minskning av en minskning av vätebroar som upprätthåller kollagenfibrer.
Andra funktioner
Prolin är oumbärlig för bildandet av veck och proteinvarv.
Dess stängda struktur gör denna aminosyra svår att "rymma" inuti proteiner, eftersom den inte kan bilda vätebroar för att "interagera" med annat närliggande avfall, det inducerar bildningen av "svängar" eller "svängar" längs proteinernas struktur Där det ligger.
Alla proteiner med en kort livstid har åtminstone en region med riklig upprepad prolin, glutamat, serin och treonin. Dessa regioner går från 12 till 60 avfall och kallas skadedjurssekvenser.
Proteiner som innehåller skadedjurssekvensen markeras av ubikvitering för efterföljande nedbrytning i proteosomer.
Biosyntes
Många aminosyror kan syntetiseras från glykolysförmedlare, pentosfosfat eller citronsyran (Krebs -cykeln). Prolin och arginin bildas på de korta glutamatvägarna.
Den praktiskt taget vanliga biosyntetiska vägen för alla levande organismer börjar med omvandlingen av L-glutamat i y-L-glutamil-5-fosfat tack vare verkan av glutamat-5-kvittande enzymet (i bakterier) eller av y-glutamil-- Whinas (hos människor).
Denna reaktion innebär ATP -beroende fosforylering, så utöver huvudprodukten genereras en ADP -molekyl.
Reaktionen katalyserad av glutamat 5-semi-limid-dehydrogenas (i bakterier) eller av y-glutamil-reduktasfosfat (hos människor) omvandlar y-l-glutamil-5-fosfatet till L-glutamat-5-Semi-limid närvaro av Co -factor nadph.
Kan tjäna dig: Half Stuart: Foundation, förberedelser och användningarL-glutamato-5-semialdehyden är reversibel och spontant dehydratiserad till (S) -1-1-pyrrool), i vars reaktion en molekyl av NADPH eller NADH också är nödvändig.
Degradering
Prolin, arginin, glutamin och histidin bryts ständigt till a-zetoglutarat för att komma in i cykeln med citronsyra eller krebs-cykel. I det speciella fallet med prolin oxideras detta först av prolinoxidasenzymet till pirrolin-5-karboxylat.
I det första steget, där oxidationen av prolin till pirrolin-5-karboxylat inträffar, accepteras de fristående protonerna av E-FAD, vilket reducerar till E-FADH2; Detta steg är exklusivt för prolinaminosyran.
På grund av en spontan reaktion transformeras pirrolin-5-karboxylat till y-semialdehydglutamat, som sedan fungerar som ett substrat för enzymglutamat y-Semi-limidiskt dehydrogenas. I detta steg dyker upp två protoner, en av dem accepteras av NAD som reduceras till NADH, och den andra är gratis i form av H+.
Arginin, som prolinen, förvandlas till y-semialdehydglutamat, men genom en alternativ metabolisk väg där två olika enzymer deltar.
Yhydrogenas. Därefter oxideras detta L-glutamat igen av ett enzymglutamatdehydrogenas, som slutligen bildar a-zetoglutarat som kommer att införlivas i citronsyran cykel.
I oxidationspassagen av glutamat frigörs en proton (H+) och en aminogrupp (NH3+). Protonen minskar en NADP+ -grupp och en NADPH -molekyl har sitt ursprung.
Trots de många likheter som finns mellan nedbrytning och biosyntesvägar för prolin och arginin, syntetiseras dessa aminosyror och nedbryts av helt motsatta vägar som använder olika enzymer, olika kofaktorer och som förekommer olika intracellulära avdelningar.
Livsmedel rika på Valina
I allmänhet har alla livsmedel med högt proteininnehåll stora mängder prolin. Bland dessa är kött, mjölk, ägg och andra. Men när vår kropp är i ett optimalt tillstånd av hälsa och näring kan den syntetisera prolin endogen.
Prolinen finns också i många baljväxter och nötter och i fullkorn som havregryn, till exempel. Andra prolinmat är vete kli, nötter, mandlar, ärtor, bönor, bland andra.
Vissa naturistbutiker formulerar vanligtvis komprimerade från aminosyrorna L-Lisina och L-Prololina kombinerade för att hjälpa människor med ledproblem eller för att försena åldrandet av vävnader.
Det har emellertid inte visat sig säkert att intag av kosttillskott av dessa aminosyror har en betydande effekt på förseningen av ålderdom eller andra förhållanden för åldersutvecklingen.
Fördelar med ditt intag
Dieter som är rika på prolin föreskrivs vanligtvis för personer som har ledsjukdomar som artrit, sprains, ligamentbrott, dislokationer, tendonit och andra, och detta beror på deras förhållande till syntesen av kollagenfibrer i kroppsanslutna vävnader.
Kan tjäna dig: agar m.R.S: Vad är, grund, förberedelser, användningarMånga av de farmakologiska lotioner och tabletter som används i den estetiska industrin är berikade med L-prolin, eftersom vissa studier har visat att denna aminosyran på något sätt kan öka kollagensyntesen och därför förbättra hudens struktur, påskynda läkningen av sår, snörningar, sår och brännskador.
I livsmedelsindustrin finns det proteiner som har "bioaktiva peptider" som träning fungerar utöver deras näringsegenskaper. Dessa peptider har i allmänhet två till nio aminosyravfall bland vilka prolin, arginin och lysin finns i överflöd.
Dessa bioaktiva peptider kan ha antihypertensiv aktivitet med en viss opioideffekt; De kan fungera som immunmodulatorer genom att stimulera immunsvaret mot vissa patogener och kan till och med orsaka ökningar av vasoaktivitet, vilket förbättrar cirkulationen för dem som konsumerar dem.
Brist
Gluten är ett protein som finns i vetekornen som orsakar tarminflammation. Människor som lider av "glutenintolerans" är kända som "celiac" -patienter och det är känt att detta protein är rikt på prolin och glutamin, vars proteolytisk nedbrytning är svår för människor med sådant tillstånd.
Vissa sjukdomar har att göra med dålig vikning av viktiga proteiner och det är mycket vanligt att dessa defekter har att göra med isomerisering Cis-trans av amida -länkar i prolinavfall, eftersom till skillnad från andra peptidlänkar där isomeren trans Det är mycket gynnat, i prolinen är det missgynnade.
I prolinavfall har det observerats att det finns en betydande tendens till bildandet av isomeren Cis först än isomeren trans I de angränsande amiderna till prolinavfall, som kan generera en "felaktig" konformation av proteiner.
Metaboliska störningar
Liksom med andra väsentliga och icke -väsentliga aminosyror måste de viktigaste patologiska störningarna relaterade till prolin göra, vanligtvis med defekter på assimileringsvägarna för denna aminosyran.
Hyperprolinemi, till exempel, är ett typiskt fall av brist i en av enzymerna som deltar i prolinnedbrytningsvägen, särskilt i 1-pyrolin-5-karboxylatdehydrogenas, vilket leder till en ansamling av dess underlag, som äntligen inaktiv väg.
Denna patologi diagnostiseras vanligtvis genom högt prolininnehåll i blodplasma och genom närvaron av 1-pyrrololin-5-karboxylatmetaboliten i urinen hos drabbade patienter som drabbats.
De viktigaste symtomen på denna sjukdom består av neurologiska störningar, njursjukdomar och förlust av hörselkapacitet eller dövhet. Andra svårare fall inkluderar allvarlig mental försening och markerade psykomotoriska svårigheter.
Referenser
- Abu-baker, s. (2015). Granskning av biokemi: koncept och anslutningar
- Delauney, a. J., & Verma, D. P. S. (1993). Prolinbiosyntes och osmoregulering i växter. Plant Journal, 4 (2), 215-223.
- Lista, b., Lerner, r. TILL., & Barbas, c. F. (2000). Prolinkatalyserade direkta asymmetriska aldolreaktioner. Journal of the American Chemical Society, 122 (10), 2395-2396
- Nelson, D. L., Lehninger, a. L., & Cox, M. M. (2008). Lehninger principer för biokemi. Macmillan.
- PLIMMER, R. H. TILL. (1912). Proteins kemiska konstitution (Vol. 1). Longmans, grönt.
- Szabados, l., & Savouré, till. (2010). Prolin: en multifunktionell aminosyra. Trender inom växtvetenskap, 15 (2), 89-97.

