Volframhistoria, egenskaper, struktur, användningar

- 2267
- 96
- Per Karlsson
han volfram, Wolframio eller Volframium är en tung övergångsmetall vars kemiska symbol är w. Det är beläget i period 6 med grupp 6 i periodiska tabellen, och dess atomnummer är 74. Hans namn har två etymologiska betydelser: hård sten och vargskum; Den andra beror på att denna metall också kallas Wolframio.
Det är en silvergrå metall och även om den är ömtålig har stor hårdhet, densitet och hög fusion och kokpunkter. Därför har det använts i alla dessa applikationer som involverar höga temperaturer, tryck eller mekaniska krafter, såsom borrar, projektiler eller strålning av filament.
 Volframstång med sin delvis oxiderade yta. Källa: Hi-reser Bilder av kemiska element [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)]
Volframstång med sin delvis oxiderade yta. Källa: Hi-reser Bilder av kemiska element [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)] Den mest kända användningen för denna metall, på en kultur och populär nivå, är i filamenten på de elektriska glödlamporna. Som har manipulerat dem kommer att inse hur bräckliga de är; De är emellertid inte gjorda av ren volfram, vilket är formbart och duktil. I metallmatriser som legeringar ger det dessutom utmärkt motstånd och hårdhet.
Det kännetecknas och kännetecknas av att vara metall med den högsta fusionspunkten, och för att vara tätare än samma ledning, överträffade endast av andra metaller som osmium och iridium. Det är också den tyngsta metallen som är känd för att möta en biologisk roll i kroppen.
I de flesta av sina joniska föreningar deltar volframanjonen, wo42-, som kan polymerisera för att orsaka kluster i ett surt medium. Å andra sidan kan volframen bilda intermetalliska föreningar, eller sterisera med metaller eller oorganiska salter så att deras fasta ämnen får olika former eller konsistenser.
Det är inte särskilt rikligt i jordens cortex, som har en ton av det bara 1,5 gram av denna metall. Eftersom det är ett tungt element är dess ursprung intergalaktiskt; Specifikt av explosionerna av supernovorna, som var tvungna att kasta "jet" av volframatomer till vår planet under deras bildning.
[TOC]
Historia
Etymologi
Tungstenens eller Wolframios historia har två ansikten såväl som deras namn: en schweizisk och den andra tyska. På 1600 -talet, i regioner som för närvarande ockuperas av Tyskland och Österrike, arbetade gruvarbetarna på koppar- och tennekstraktioner för att producera brons.
Då träffade gruvarbetarna en torn i processen: det fanns ett extremt svårt mineral; Mineral bestod av Wolframite, (tro, mn, mg) wo4, som behöll eller "förtärde" tenn som om det var en varg.
Därför etymologin för detta element, "varg" av varg på spanska, en varg som åt tenn; och 'ram' av skum eller grädde, vars kristaller liknade en lång svart päls. Det var så att namnet 'Wolfram' eller 'Wolframio' dök upp för att hedra dessa första observationer.
1758, på den schweiziska sidan till ett liknande mineral, Scheelita, Cawo4, Han fick namnet 'Tung Sten', vilket betyder 'Hard Stone'.
Båda namnen, Wolframio och Tungsten, används allmänt omväxlande, beroende på enbart beroende på kultur. I Spanien, till exempel, och i Europeiska väst, är denna metall känd mer av Wolframio; Medan i den amerikanska kontinenten dominerar namnet på volframet.
Erkännande och upptäckt
Det var då känt att mellan sjuttonde och artonde århundradet fanns det två mineraler: Wolframite och Scheelita. Men vem skymtade att det fanns en annan metall än de andra? De kunde bara karakteriseras som mineraler, och det var 1779 som den irländska kemisten Peter Woulfe noggrant analyserade Wolframite och härledde förekomsten av Wolframium.
Det kan tjäna dig: perbrominsyra (HBRO4): Egenskaper, risker och användningarPå den schweiziska sidan, återigen, kunde Carl Wilhelm Scheele 1781 isolera volframen som wo3; Och ännu mer fick han tumatisk (eller wolphramic) syra, h2Wo4 och andra föreningar.
Detta räckte emellertid inte för att nå ren metall, eftersom det var nödvändigt att minska denna syra; det vill säga utsätta det för en sådan process som inte kan syre och kristallisera som metall. Carl Wilhelm Scheele hade inte lämplig metod för denna kemiska reduktionsreaktion.
Det är här de spanska bröderna D'Aluyar, Fausto och Juan José, som minskade båda mineralerna (Wolframite och Scheelita) med kol, i staden Bergara, i staden Bergara. Två beviljas meriter och ära att vara upptäckarna av Wolframium eller Metallic Tungsten (W).
Stål och glödlampor
 Varje glödlampa med volframtråd. Källa: Pxhere.
Varje glödlampa med volframtråd. Källa: Pxhere. Liksom andra metaller definierar dess användning dess historia. Bland de mest framträdande i slutet av 1800-talet var stål-volframlegeringarna och volframfilamenten för att ersätta kol inuti de elektriska glödlamporna. Det kan sägas att de första glödlamporna, som vi känner dem, marknadsfördes 1903-1904.
Egenskaper
Fysiskt utseende
Det är en silver och glansig grå metall. Bräcklig men av stor hårdhet (inte förvirrande med uthållighet). Om stycket är av hög renhet blir det formbart och hårt, både eller fler och flera stål.
Atomnummer
74.
Molmassa
183,85 g/mol.
Smältpunkt
3422ºC.
Kokpunkt
5930ºC.
Densitet
19,3 g/ml.
Fusionsvärme
52,31 kJ/mol.
Förångningsvärme
774 kJ/mol.
Molvärmekapacitet
24,27 kJ/mol.
Moh hårdhet
7.5.
Elektronnegativitet
2,36 på Pauling -skalan.
Atomradio
139
Elektrisk resistans
52.8 nΩ · m vid 20 ° C.
Isotoper
Det presenterar främst i naturen som fem isotoper: 182W, 183W, 184W, 186W och 180W. Enligt den molmassan på 183 g/mol, som i genomsnitt har atommassorna av dessa isotoper (och de andra trettio radioisotoperna), har varje atom av volfram eller wolframium cirka hundra tio neutroner (74 + 110 = 184).
Kemi
Det är en mycket resistent mot korrosionsmetall, eftersom dess tunna skikt av wo3 skyddar det mot attacken av syre, syra och alkalier. När de har lösts upp och utfällts med andra reagens erhålls deras salter, som kallas Wolframates eller volframat; I dem har volframet ett oxidationstillstånd på +6 (förutsatt att det finns katjoner w6+).
Syran
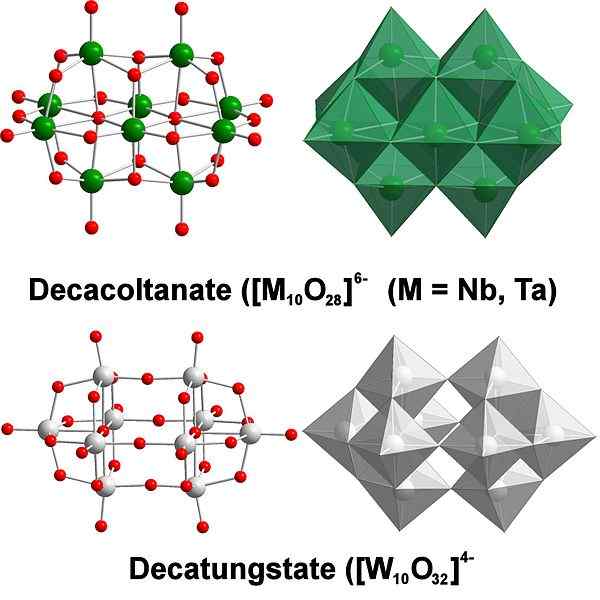 Decatungstate, ett exempel på volfram polyaxometalater. Källa: SCIFANZ [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]
Decatungstate, ett exempel på volfram polyaxometalater. Källa: SCIFANZ [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] Kemiskt är volframen ganska speciell eftersom dess joner tenderar att grupperas (kluster på engelska) för att bilda heteropolycider eller polyaxometalat. Vad är dem? De är grupper eller kluster av atomer som binder för att definiera en trepimensionell kropp; främst en med sfärisk burstruktur, där de "omsluter" en annan atom.
Allt börjar från volframanjonen, wo42-, Vilket i surt medium är protonerat (HWO4-) och kopplad till en angränsande anjon för att bilda [W2ANTINGEN7(ÅH)2]2-; Och detta i sin tur går med en annan [W2ANTINGEN7(ÅH)2]2- Att komma från [w4ANTINGEN12(ÅH)4]4-. Så vidare tills det finns flera polytungstater.
Kan tjäna dig: litiumklorid (LICL): egenskaper, risker och användningarParathungstate A och B, [W7ANTINGEN24]6- och h2W12ANTINGEN4210-, respektive är de en av de mest enastående av dessa polyader.
Det kan bli en utmaning att överväga sina skiss- och Lewis -strukturer; Men det räcker i princip för att visualisera dem som wo octahedra -uppsättningar6 (övre bild).
Observera att dessa gråaktiga oktaedra slutar definiera Decatungstate, en politungstat; Om en heteroátomo låses inuti (till exempel fosfor), skulle det då vara ett polyaxometalat.
Elektronisk struktur och konfiguration
Kristallinfaser
Volframatomer definierar en kubisk struktur centrerad med kroppen (BCC, av Kroppscentrerad kubik). Denna kristallina form är känd som a -fasen; Medan p -fasen också är kubisk, men lite tät. Både faser eller kristallina former, a och ß, kan samexistera i balans under normala förhållanden.
De kristallina kornen i a -fasen är isometriska, medan de i ß -fasen liknar kolumner. Oavsett hur glaset är, i denna regering. Annars kunde de höga smält- och kokpunkterna inte förklaras, eller den höga hårdheten och densiteten hos volfram.
Metalllänk
Volframatomer måste på något sätt vara mycket förenade. För att höja en antagande bör den elektroniska konfigurationen av denna metall observeras tidigare:
[Xe] 4f145 D46s2
5D -orbitaler är mycket stora och suddiga, vilket skulle innebära att mellan två nära atomer W finns effektiva omloppsöverlappningar. Dessutom bidrar Orbitals 6s till de resulterande banden, men i mindre utsträckning. Medan 4F -orbitalerna har "mycket djupt ner" och deras bidrag därför till den metalliska länken är lägre.
Detta, storleken på atomerna och de kristallina kornen, är variablerna som bestämmer volframens hårdhet och dess densitet.
Oxidationstillstånd
I volfram eller metallisk wolframium har atomerna w noll oxidationstillstånd (w0). Återvända till elektronisk konfiguration kan 5D- och 6S -orbitaler "tömma" elektroner beroende på om W är i sällskap med mycket elektronegativa atomer, såsom syre eller fluor.
När de två 6s -elektronerna går förlorade har volframen oxidationstillstånd +2 (W2+), Vad genererar att dess atomkontrakt.
Om du också tappar alla elektroner i dina 5D -orbitaler kommer din oxidationsstatus att bli +6 (W6+); Härifrån kan det inte bli mer positivt (i teorin), eftersom 4F -orbitalerna för att vara inre skulle kräva stora energier för att ta bort sina elektroner. Det vill säga att det mest positiva oxidationstillståndet är +6, där volframen ännu har liten.
Denna volfram (VI) är mycket stabil under sura förhållanden eller i många syresatta eller halogenerade föreningar. Andra positiva och möjliga oxidationstillstånd är: +1, +2, +3, +4, +5 och +6.
Volfram kan också få elektroner om de kombineras med mindre elektronegativa atomer än honom. I detta fall blir deras atomer större. Det kan få högst fyra elektroner; det vill säga ha ett oxidationstillstånd på -4 (w4-).
Erhållande
Tidigare nämndes att volframet finns i Wolframite och Scheelita mineraler. Beroende på processen erhålls två föreningar från dem: volframoxid, wo3, eller ammonium paratungstate, (NH4)10(H2W12ANTINGEN42) · 4h2O (eller ATP). Någon av dem två kan reduceras till metalliskt med kol över 1050 ° C.
Det kan tjäna dig: RAAULT LAG: Princip och formel, exempel, övningarDet är inte ekonomiskt lönsamt. Det är därför det är att föredra att producera det i form av damm för att en gång hantera andra metaller för att få legeringar.
Det är värt att nämna att Kinas värld är landet med den största produktionen av volfram. Och på den amerikanska kontinenten, Kanada, Bolivia och Brasilien, upptar de också listan över de största producenterna av denna metall.
Ansökningar
 En volframkarbidförening: Ett exempel på hur hårdheten hos denna metall kan användas för att odödliggöra och härda material. Källa: SOLITYANGEL (SOLITYANGEL) [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
En volframkarbidförening: Ett exempel på hur hårdheten hos denna metall kan användas för att odödliggöra och härda material. Källa: SOLITYANGEL (SOLITYANGEL) [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] Några av de kända användningarna för denna metall nämns nedan:
-Hans salter användes för att måla Cottons of Old Theaters outfit.
-Kombinerat med stål härdar det ännu mer, till och med att kunna motstå mekaniska snitt i höga hastigheter.
-Volfram sintring filament har använts i mer än hundra år i elektriska glödlampor och halogenerade lampor. På grund av dess höga smältpunkt har den också fungerat som material för katodstrålarör och för raketmotorer munstycken.
-Ersätter bly i tillverkningen av projektiler och radioaktiva sköldar.
-Volfram -nankablar kan användas i pH -känsliga nanodispositiva.
-Volframkatalysatorer användes för att hantera svavelproduktion i oljeindustrin.
-Volframkarbid kommer från alla dess föreningar som täcker mer användning. Från förstärkning av snitt och borrverktyg, eller tillverkning av militära beväpningar, till mekanisation av trä, plast och keramik.
Risker och försiktighetsåtgärder
Biologisk
Att vara en relativt sällsynt metall i jordskorpan är dess negativa effekter knappa. I sura jordar kanske polytungstater inte påverkar de enzymer som används av molybdate; Men i grundläggande jordar, wo42- Det ingriper (positivt eller negativt) i moo -metaboliska processer42- och koppar.
Växterna kan till exempel absorbera de lösliga föreningarna i volfram, och genom att äta dem ett djur och sedan efter att ha konsumerat sitt kött, kommer vi att komma in i våra organismer. De flesta utvisas i urin och avföring, och lite är känt vad som händer med resten av dem.
Djurstudier visade att när höga koncentrationer av volframpulver utvecklar symtom som liknar lungcancer.
Genom intag skulle en vuxen människa behöva dricka tusentals liter vatten berikade med volframsalter för att visa en märkbar hämning av colinesteras och fosfatasenzymer.
Fysisk
I allmänna termer är volfram ett litet giftigt element, och det finns därför få värdrisker för hälsoskador.
När det gäller Metallic Tungsten bör du undvika att andas damm; Och om provet är fast måste det beaktas att det är mycket tätt och att det kan orsaka fysiska skador om det faller eller träffar andra ytor.
Referenser
- Klocka. (s.F.). Tungsten (Wolfram): Egenskaper, produktion, applikationer och legeringar. Balansen. Återhämtat sig från: TheBalance.com
- Wikipedia. (2019). Volfram. Hämtad från: i.Wikipedia.org
- Lentech B.V. (2019). Volfram. Återhämtat sig från: Lentech.com
- Jeff Desjardins. (1 maj 2017). Tungstenens historia, den starkaste naturliga metallen på jorden. Återhämtat sig från: visualcapitalist.com
- Doug Stewart. (2019). Volframelement fakta. Återhämtat sig från: Chemicool.com
- Art Fisher och Pam Powell. (s.F.). Volfram. Nevada University. Återhämtat sig från: unce.a r.Edu
- Helmestine, Anne Marie, PH.D. (2 mars 2019). Fakta med volfram eller Wolfram. Återhämtat sig från: tankco.com

