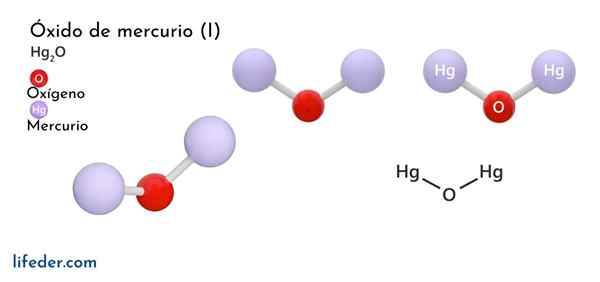
Kvicksilveroxid (Hg2O)
- 3619
- 445
- Prof. Erik Johansson
Vad är kvicksilveroxid?
han Kvicksilveroxid (I) u järnoxid, vars kemiska formel representeras som Hg2Eller, det är en solid fasförening, betraktad som toxisk och instabil ur den kemiska synvinkeln och förvandlas till kvicksilver till dess elementära form och kvicksilveroxid (II).
Det finns bara två kemiska arter som kan bilda kvicksilver i kombination med syre, eftersom denna metall har två enda oxidationstillstånd (Hg+ och Hg2+): Mercury Oxide (I) och Mercury Oxide (II). Kvicksilveroxid (II) är i ett tillstånd av fast aggregering och erhåller i två relativt stabila kristallina former.
Denna förening är också känd helt enkelt som kvicksilveroxid, så endast denna art kommer att behandlas här. En mycket vanlig reaktion som inträffar med detta ämne är att när de är föremål för uppvärmning inträffar nedbrytningen, vilket producerar kvicksilver och gasformigt syre i en endotermisk process.
Kemisk struktur
Under atmosfäriska tryckförhållanden presenteras denna art i två kristallina former: en så kallad cinabrio och en annan känd som en montrodit, vilket är mycket sällsynt. Båda formerna omvandlas till tetragonal över 10 GPa tryck.
Strukturen på cinnabrio är baserad på primitiva hexagonala celler (HP6) med trigonal symmetri, vars spiralformiga axel är orienterad till vänster (P32tjugoett); Å andra sidan är strukturen för montroditen ortorrombisk, baserad på ett primitivt rutnät som bildar plan för glidande vinkelrätt mot de tre axlarna (PNMA).
Däremot kan två former av kvicksilveroxid visuellt särskiljas, eftersom den ena är röd och den andra gul. Denna skillnad i färg inträffar tack vare partikelns dimensioner, eftersom de två formerna har samma struktur.
Det kan tjäna dig: cirkonium: historia, egenskaper, struktur, risker, användningarFör att producera den röda formen av kvicksilveroxid, metallisk kvicksilveruppvärmning i syre vid en temperatur runt 350 ° C, eller till kvicksilvernitratpyrolysprocessen (ii) (Hg (NO3)2).
På samma sätt, för att producera den gula formen på denna oxid2+ i vattenhaltig form med en bas.
Kvicksilveroxidegenskaper
- Den har en smältpunkt på cirka 500 ° C (motsvarande 773 K), över vilken den lider av sönderdelning och en molmassa eller molekylvikt på 216,59 g/mol.
- Det är i ett tillstånd av fast aggregering i olika färger: orange, röd eller gul, enligt graden av spridning.
- Det är en oxid av oorganisk natur, vars andel med syre är 1: 1, vilket gör det till en binär art.
- Det anses vara olösligt i ammoniak, aceton, eter och alkohol, liksom i annan organisk natur.
- Dess löslighet i vatten är mycket låg, är ungefär 0,0053 g/100 ml vid standardtemperatur (25 ° C) och ökar med ökningen av temperaturen.
- Det anses vara lösligt i de flesta syror; Den gula formen visar emellertid större reaktivitet och större kapacitet för upplösning.
- När kvicksilveroxiden utsätts för nedbrytningen, medan dess röda form gör det när den utsätts för ljuskällor.
- Genom att utsättas för upphettning av temperaturen där han bryter ner släpper han med hög toxicitet kvicksilvergaser.
- Endast när det värms upp till 300-350 ° C Kvicksilver kan kombineras med syre till en lönsam takt.
Kan tjäna dig: kemiska suspensionerAnvändning/applikationer
Det används som en föregångare för att erhålla elementärt kvicksilver, eftersom det lider av nedbrytningsprocesser på ett ganska enkelt sätt; I sin tur, när det sönderfaller det producerar syre i sin sodaform.
På liknande sätt används denna oorganiska naturoxid som ett värde -rankande medel av standardtyp för anjoniska arter, eftersom en förening genereras som har större stabilitet än dess initiala form.
I detta avseende upplever kvicksilveroxid upplösning när den finns i koncentrerade lösningar av basarter, vilket producerar föreningar som kallas hydroxokomplex.
Dessa föreningar är komplexa med m strukturx(ÅH)och, där M representerar en metallatom och abonnemang x y y representerar antalet gånger som arter finns i molekylen. De är av enormt nytta i kemiska undersökningar.
Dessutom kan kvicksilveroxid (II) användas i laboratorier för produktion av olika metallsalter; Till exempel kvicksilveracetat (II), som används i organiska syntesprocesser.
Denna förening används också, när den blandas med grafit, som ett material för den katodiska elektroden vid produktion av kvicksilverbatterier och elektricitet och zinkoxid -typceller.
Risker
- Detta ämne, som manifesterar grundläggande egenskaper på ett mycket svagt sätt, är ett mycket användbart reagens för olika tillämpningar som de som nämns ovan, men i sin tur presenterar viktiga risker för människan när de utsätts för detta.
- Kvicksilveroxid har hög toxicitet och kan absorberas av luftvägarna, eftersom den avger irriterande gaser när det är i form av aerosol, förutom att vara extremt giftig om den blir intaget eller om den absorberas av huden när det kommer i kontakt direkt med detta.
Kan tjäna dig: Chirality- Denna förening ger ögonirritation och kan orsaka skador på njurarna som därefter härstammar i problem med njursvikt.
- När den konsumeras på ett eller annat sätt av vattenlevande arter är denna kemikalie bioacumula i dessa och påverkar organismen hos människor som regelbundet konsumerar dem.
- Uppvärmningen av kvicksilveroxid härstammar kvicksilverångor som har hög toxicitet utöver gas syre, vilket ökar risken för brandfarlighet; det vill säga att producera bränder och förbättra förbränningen i dessa.
- Denna oorganiska oxid har ett kraftfullt oxiderande beteende, så den ger våldsamma reaktioner när den kommer i kontakt med reducerande medel och vissa kemiska ämnen som svavelklorid (CL2S2), väteperoxid (h2ANTINGEN2), klor och magnesium (endast när han värms upp).