Kiseloxid (SiO2) struktur, egenskaper, användningar, erhållning

- 3964
- 571
- Johan Olsson
han kiseloxid Det är ett oorganiskt fast ämne som bildas av föreningen av en kiselatom och två syre. Dess kemiska formel är SIO2. Denna naturliga förening kallas också kisel eller kiseldioxid.
Sio2 Det är det vanligaste mineralet i jordskorpan, eftersom sanden består av kiseldioxid. Enligt dess struktur kan kiseldioxid vara kristallin eller amorf. Det är olösligt i vatten, men upplöses i alkalier och i fluorhorinsyra HF.
 Sanden är en källa till kiseldioxid SIO2. ರವಿಮುಂ [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons.
Sanden är en källa till kiseldioxid SIO2. ರವಿಮುಂ [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons. Sio2 Det finns också i strukturen för vissa växter, bakterier och svampar. Även i skelett av marina organismer. Förutom sanden finns det också andra typer av stenar som är kiseldioxid.
Kiseldioxid har en mycket utbredd användning som uppfyller olika funktioner. Den mest utbredda användningen är som filtreringsmaterial av vätskor som oljor och oljeprodukter, drycker som öl och vin samt fruktjuicer.
Men det har många andra applikationer. En av de mest användbara och viktiga är att tillverka bioaktivt glas, som tillåter "ställning" där benceller växer till att producera bendelar på grund av olycka eller sjukdom.
[TOC]
Strukturera
Kiseldioxid2 Det är en tre -atommolekyl, där kiselatomen är kopplad till två syreatomer med kovalenta bindningar.
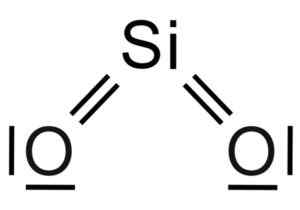 SIO -molekylens kemisk struktur2. Grasso Luigi [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons.
SIO -molekylens kemisk struktur2. Grasso Luigi [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons. Den strukturella enheten för fast kiseldioxid som sådan är en tetrahedron där en kiselatom är omgiven av 4 syreatomer.
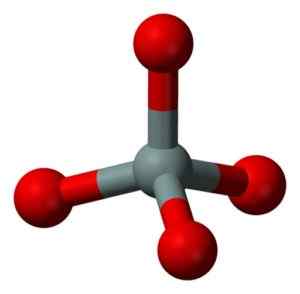 Strukturell enhet av fast kiseldioxid: grå = kisel, röd = syre. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons.
Strukturell enhet av fast kiseldioxid: grå = kisel, röd = syre. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons. Tetrahedra binder till varandra som delar syreatomerna i deras sammanhängande vertikaler.
Det är därför en kiselatom delar i hälften av var och en av de fyra syreatomerna och detta förklarar förhållandet i föreningen av 1 kiselatom vid 2 syreatomer (SIO2).
 Tetrahedra delar syre i SIO2. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons.
Tetrahedra delar syre i SIO2. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons. SIO -föreningar2 De är indelade i två grupper: kristallin kiseldioxid och amorfa kiseldioxid.
Kristallina kiseldioxidföreningar har strukturer med repetitiva mönster av kisel och syre.
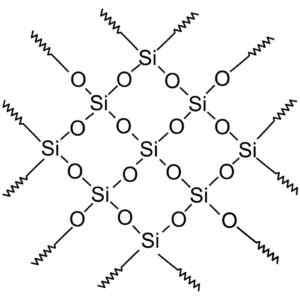 Kristallin kiseldioxid har repetitiva enheter. Wersję Rastrową Wykonał Użytkownik Polskiego Projektu Wikipedii: Polyimerek, Zwektoryzował: Krzysztof Zajączkowski [GFDL (http: // wwww.gnu.Org/copyleft/fdl.html)]. Källa: Wikimedia Commons.
Kristallin kiseldioxid har repetitiva enheter. Wersję Rastrową Wykonał Użytkownik Polskiego Projektu Wikipedii: Polyimerek, Zwektoryzował: Krzysztof Zajączkowski [GFDL (http: // wwww.gnu.Org/copyleft/fdl.html)]. Källa: Wikimedia Commons. All kiseldioxidkristall kan betraktas som en jättemolekyl där det kristallina nätverket är mycket starkt. Tetrahedra kan kopplas på olika sätt, vilket ger upphov till olika kristallina former.
Kan tjäna dig: Bravais Networks: koncept, egenskaper, exempel, övningarI amorf kiseldioxid är strukturerna slumpmässigt kopplade, utan att följa ett regelbundet mönster mellan molekylerna och dessa är i ett annat rumsligt förhållande en med varandra.
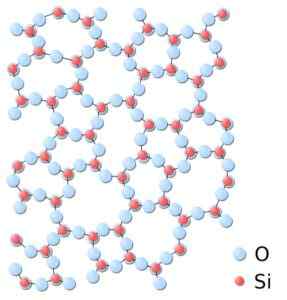 I amorf kiseldioxid är fackföreningarna inte repetitiva eller enhetliga. Kisel.Svg: *kiseldioxid.JPG: I: Användare: jDrewittderivevative Work: Matt [Public Domain]. Källa: Wikimedia Commons.
I amorf kiseldioxid är fackföreningarna inte repetitiva eller enhetliga. Kisel.Svg: *kiseldioxid.JPG: I: Användare: jDrewittderivevative Work: Matt [Public Domain]. Källa: Wikimedia Commons. Nomenklatur
-Kiseloxid
-Kiseldioxid
-Kisel
-Kvarts
-Tridimita
-Cristobalita
-Dioxosilan
Egenskaper
Fysiskt tillstånd
Färg färglös till grå.
 Sioprov2 ren. LHCHEM [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons.
Sioprov2 ren. LHCHEM [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons. Molekylvikt
60,084 g/mol
Smältpunkt
1713 ºC
Kokpunkt
2230 ºC
Densitet
2,17-2,32 g/cm3
Löslighet
Olöslig i vatten. Amorf kiseldioxid är löslig i alkalier, särskilt om det är fint uppdelat. Löslig i fluorhorhorinsyra HF.
Amorf kiseldioxid är mindre hydrofil, det vill säga mindre relaterat till vatten än det kristallina.
Kemiska egenskaper
Sio2 o Kiseldioxid är i huvudsak inert för de flesta ämnen, det är väldigt lite reaktivt.
Motstår attacken av klor CL2, Bromo br2, Väte h2 och av de flesta syror vid rumstemperatur eller något högre. Attackeras av fluor f2, HF fluorhorhorinsyra och alkalier såsom natriumkarbonat2Co3.
Sio2 Det kan kombineras med metallelement och oxider för att bilda silikater. Om kiseldioxid smälter med alkaliska metallkarbonater vid ungefär 1300 ° C, erhålls alkaliska silikater2.
Det är inte bränsle. Den har låg värmeledningsförmåga.
Närvaro
Den huvudsakliga kiseldioxidkällan är sand.
Sio2 O Silicera är i form av tre kristallina sorter: kvarts (den mest stabila), Tridimita och Cristobalita. Amorfant för kiseldioxid är Agata, Jaspe och Ónice. Opal är en amorf hydratiserad kiseldioxid.
Det finns också den så kallade biogen kiseldioxiden, det vill säga den som genereras av levande organismer. Källor till denna typ av kiseldioxid är bakterier, svampar, diatomer, havsvampar och växter.
De ljusa och hårda delarna av bambu och halmen innehåller kiseldioxid, och skeletten i vissa marina organismer har också en stor del av kiseldioxid; Men de viktigaste är diatomatorer.
Diatomea Lands är geologiska produkter av förfallna encelliga organismer (alger).
Kan tjäna dig: kosmiskt dammAndra typer av naturliga kiseldioxid
I naturen finns det också följande sorter:
- Glasformiga silikaner som är vulkaniskt glas
- Milleritas som är naturligt glas som produceras genom sammansmältningen av kiselhaltig material under påverkan av meteoriter
- Den smälta kiseldioxid som är uppvärmd kiseldioxid till vätskan och kyld fas utan att tillåta en kristallisk
Erhållande
Kiseldioxid från arenor erhålls direkt från stenbrottet.
 Arena stenbrott i Kalifornien. Ruff Tux Cream Puff [CC0]. Källa: Wikimedia Commons.
Arena stenbrott i Kalifornien. Ruff Tux Cream Puff [CC0]. Källa: Wikimedia Commons. Diatomiten eller diatomerna erhålls också på detta sätt med liknande grävmaskiner och utrustning.
Amorf kiseldioxid framställs baserat på vattenhaltig alkalisk metallsilikatlösningar (såsom natrium Na) genom neutralisering med syra, såsom svavelsyra H2Sw4, HCL -saltsyra eller koldioxid2.
Om lösningens slutliga pH är neutralt eller alkaliskt, erhålls utfällt kiseldioxid. Om pH är syra erhålls gelsilikakisla.
Pyrogen kiseldioxid framställs genom förbränning av en flyktig kiselförening, vanligtvis kisel Sicl -tetraklorid4. Den utfällda kiseldioxid erhålls från en vattenlösning av silikater till vilken syra tillsätts.
Kolloidal kiseldioxid är en stabil spridning av amorfa kiseldioxidkolloidala partiklar i en vattenhaltig lösning.
Ansökningar
I flera applikationer
Kiseldioxid2 Den har ett brett utbud av funktioner, till exempel fungerar det som slipande, absorberande, antiapelmazante, fylld, opacifying och för att gynna avstängningen av andra ämnen, bland många andra arbetssätt.
Det används till exempel:
-I glas, keramisk, eldfast, slipande och löslig glasstillverkning
-Missfärgning och rening av oljor och oljeprodukter
-I formar för gjuteri
-Som antiapelmazante av pulver av alla slag
-Som antispumant
-För att filtrera vätskor som torrtvättlösningsmedel, vatten i poolerna och kommunala och industriella avloppsvatten
-Vid tillverkning av värmeisolatorer, brandsäkra tegelstenar och förpackningsmaterial som är motståndskraftiga mot eld och syror
-Som att fylla i tillverkningen av papper och kort, för att göra dem mer motståndskraftiga
-Som fylld med målningar för att förbättra dess flöde och färg
-I material för metallpolering och trä, när de ger dem slipmedel
-I kemiska analyser laboratorier i kromatografi och som absorberande medel
-Som antiapelmazante av insektsmedel och agrokemiska formler, för att hjälpa malning av bekämpningsmedel och som bärare av den aktiva föreningen
-Som katalysatorstöd
-Som fyllning för att förstärka syntetiskt gummi och gummi
Kan tjäna dig: longitudinella vågor: egenskaper, skillnader, exempel-Som en bärare av vätskor i djurmat
-I tryckta bläck
-Som torkmedel och adsorbent, i form av kiseldioxidgel
-Som tillsatsmedel i cement
-Som husdjurssand
-I mikroelektronikisolatorer
-I termoptiska omkopplare
 Kiselgel. Kenpei [CC BY-SA 3.0 (http: // Creativecommons.Org/licenser/BY-SA/3.0/]]. Källa: Wikimedia Commons.
Kiselgel. Kenpei [CC BY-SA 3.0 (http: // Creativecommons.Org/licenser/BY-SA/3.0/]]. Källa: Wikimedia Commons. I livsmedelsindustrin
En amorf kiseldioxid införlivas i en mängd olika livsmedelsprodukter som en multifunktionell direkt ingrediens i olika typer av mat. Du bör inte överstiga 2% av den färdiga maten.
Till exempel fungerar det som antiapelmazante (för att förhindra att vissa livsmedel fastnar), som en stabilisator i produktionen av öl, som en antiprecipitator, för att filtrera vin, öl och fruktjuicer eller grönsaker.
 Team för vinfiltrering med diatomer (SIO2). Fabio Ingroso [CC av 2.0 (https: // CreativeCommons.Org/licenser/av/2.0)]. Källa: Wikimedia Commons.
Team för vinfiltrering med diatomer (SIO2). Fabio Ingroso [CC av 2.0 (https: // CreativeCommons.Org/licenser/av/2.0)]. Källa: Wikimedia Commons. Det fungerar som ett flytande absorberande i vissa livsmedel och komponent av mikrokapslar för smaksoljor.
Dessutom SIO2 Amorf används genom en speciell process på ytan av artiklarnas plast för att packa mat och fungerar som en barriär.
I läkemedelsindustrin
Det läggs till som ett antiapelmazante -medel, förtjockning, gelning och som en elcipient, det vill säga som assistent för att forma flera läkemedel och vitaminer.
Inom kosmetikindustrin och personlig vård
Det används i en mängd produkter: i ansiktspulver, ögonskuggor, ögonöglor, läppstift, färg, sminkskydd, talkos, fötter pulver, hårfärgningar och blekmedel och blekmedel.
Också i oljor och badsalter, skumbad, händer och kroppskräm.
Också i natthydreringskrämer, ljusstyrka och nagelfärg.
I terapeutiska tillämpningar
Sio2 Det finns i bioaktivt eller biovidrios glas vars huvudkarakteristik är att de kan reagera kemiskt med den biologiska miljön som omger dem och bildar en stark och hållbar koppling till den levande vävnaden.
Denna typ av material tjänar till att göra benersättare som ansiktet, till exempel "ställning" där benceller kommer att växa. De har visat god biokompatibilitet med både ben och mjuka vävnader.
Dessa biovidrios tillåter att återhämta ben från ansiktet till människor som har tappat dem av misstag eller sjukdom.
Risker
Mycket tunna kiseldioxidpartiklar kan hängas upp i luften och bildar icke -explosiva pulver. Men detta damm kan irritera huden och ögonen. Dess inandning orsakar irritation i luftvägarna.
Dessutom ger inandning av kiseldioxid damm långvarig skada på lungorna, kallad silikos.
Referenser
- ELLER.S. National Library of Medicine. (2019). Kiseldioxid. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Bomull, f. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- Da silva, m.R. et al. (2017). Gröna extraktionstekniker. Kiseldioxidbaserade sorbnts. Genom att förstå analytisk kemi. Återhämtat sig från Scientedirect.com.
- Ylänen, h. (redaktör). (2018). Bioaktiva glasögon: Material, egenskaper och applikationer (andra upplagan). Annars. Återhämtat sig från böcker.Google.co.gå.
- Windholz, m. et al. (redaktörer) (1983) Merck Index. En encyklopedi av kemikalier, drarugs och biologiska. Tionde upplagan. Merck & Co., Inkl.
- Mäkinen, j. Och Suni, T. (2015). Tjockfilm soi wafers. I Handbook of Silicon Based MEMS Materials and Technologies (andra upplagan). Återhämtat sig från Scientedirect.com.
- Sirleto, l. et al. (2010). Termooptiska omkopplare. Kisel nanokristaller. Återhämtat sig från Scientedirect.com.
- « Kalciumfluorid (CAF2) struktur, egenskaper, användningar
- 275 Pyropos för romantiska och sexiga män »

