Kalciumfluorid (CAF2) struktur, egenskaper, användningar

- 1471
- 267
- Johan Gustafsson
han kalciumfluorid Det är ett oorganiskt fast ämne som bildas av en kalciumatom (CA) och två fluoratomer (F). Dess kemiska formel är CAF2 Och det är en kristallin grå -vit fast.
I naturen finns det i fluoritmalm eller sparkfluor. Det finns naturligt i ben och tänder. Fluoritmineral är den huvudsakliga källan som används för att få andra fluorföreningar.
 CAF -kalciumfluorid2 fast. W: Användare: Walkerma i juni 2005. Källa: Wikimedia Commons.
CAF -kalciumfluorid2 fast. W: Användare: Walkerma i juni 2005. Källa: Wikimedia Commons. Dessutom kaffet2 Det används för att förebygga karies i tänderna, så det läggs till material som används av tandläkare för att bota dem. I själva verket läggs kalciumfluorid också till dricksvatten (vatten som kan drickas) så att befolkningen drar nytta av att äta och borsta tänderna.
Kaf2 Det används i stora kristaller i optisk utrustning och kameror. Det används också i små enheter som tjänar till att upptäcka hur mycket en person har utsatts för radioaktivitet.
[TOC]
Strukturera
CAF -kalciumfluorid2 Det är en jonisk förening bildad av en CA -kalciumkation2+ och två fluorfer-. Vissa informationskällor indikerar dock att deras länkar har en viss kovalent karaktär.
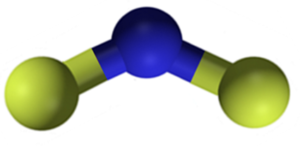 CAF -kalciumfluoridstruktur2. Blått: kalcium; Gul fluor. Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons.
CAF -kalciumfluoridstruktur2. Blått: kalcium; Gul fluor. Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons. Nomenklatur
Kalciumfluorid
Egenskaper
Fysiskt tillstånd
Färgs solid till gråaktig vit med kubisk kristallin struktur.
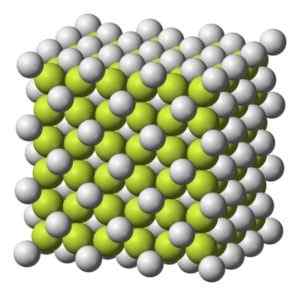 Kubisk kristallin struktur av kaffe2. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons.
Kubisk kristallin struktur av kaffe2. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons. Molekylvikt
78,07 g/mol
Smältpunkt
1418 ºC
Kokpunkt
2533 ºC
Densitet
3,18 g/cm3 vid 20 ° C.
Brytningsindex
1 4328
Löslighet
Det är olösligt i vatten vid 20 ° C. Nästan olöslig vid 25 ° C: 0,002 g/100 ml vatten. Något surt lösligt.
Kemiska egenskaper
Dess oxiderande eller reducerande egenskaper är mycket svaga, men dessa reaktioner kan inträffa. Även i mycket få fall.
Det är inert för organiska kemiska föreningar och många syror, inklusive HF -fluorhorinsyra. Det löses långsamt i salpetersyra3.
Kan tjäna dig: Millikan Experiment: Procedure, Förklaring, betydelseDet är inte brandfarligt. Reagerar inte snabbt med luft eller vatten.
På grund av dess lilla affinitet för vatten, även om den utsätts för en hög andel fukt, påverkar den inte ens på en månad vid normal rumstemperatur.
I närvaro av fukt upplöses väggarna i deras kristaller långsamt vid temperaturer över 600 ° C. I torra miljöer kan det användas upp till cirka 1000 ° C utan att påverkas märkbart.
Närvaro
CAF -kalciumfluorid2 Det finns naturligtvis i fluoritmalm eller spatt fluorid.
Även om kaffet2 Ren är färglös, fluoritmineral är ofta färgad av närvaron av elektroner fångade i "hålen" i den kristallina strukturen.
Detta mineral är mycket uppskattat för sin glasartade ljusstyrka och olika färger (lila, blå, grön, gul, färglös, brun, rosa, svart och rödaktig orange). Det sägs vara "världens mest färgade mineral".
 Fluorit av en gruva i Frankrike. Toulouse Muséum [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons.
Fluorit av en gruva i Frankrike. Toulouse Muséum [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons. Fluorit (blå kristaller) i Natural Museum of Milan. Giovanni dall'orto [cc by-sa 2.5 it (https: // creativecommons.Org/licenser/BY-SA/2.5/IT/DEED.i)]. Källa: Wikimedia Commons.
Fluorit (blå kristaller) i Natural Museum of Milan. Giovanni dall'orto [cc by-sa 2.5 it (https: // creativecommons.Org/licenser/BY-SA/2.5/IT/DEED.i)]. Källa: Wikimedia Commons. Fluorit av en gruva i England. Didier Descuens [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons.
Fluorit av en gruva i England. Didier Descuens [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons. Fluorit av en gruva i Frankrike. Didier Descuens [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons.
Fluorit av en gruva i Frankrike. Didier Descuens [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons.
 Fluorit av en gruva i USA. Författare: Oliveira Jurema. Källa: Wikimedia Commons.
Fluorit av en gruva i USA. Författare: Oliveira Jurema. Källa: Wikimedia Commons. Kalciumfluorid finns också i ben i mängder mellan 0,2 och 0,65%, och även i tändernas emalj i 0,33-0,59%.
Ansökningar
- Vid erhållning av fluorföreningar
Fluorita caf2 Det är den grundläggande eller majoritetskällan för fluor över hela världen. Det är råmaterialet att framställa nästan alla fluorföreningar.
Det viktigaste av dessa är HF fluorhorhorinsyra, från vilken de andra fluorkade föreningarna bereds. Fluoridjonen f- Det frigörs från mineralet genom reaktion av detta med koncentrerad svavelsyra h2Sw4:
Kan tjäna dig: isomeriaKaf2 (fast) + h2Sw4 (vätska) → Fall4 (fast) + 2 HF (gas)
- I tandvård
CAF -kalciumfluorid2 Det är en agent för kariesförebyggande. Det används för att fluorisera drickbara vatten (vatten som kan dricka) med det målet.
Dessutom är de låga fluoridkoncentrationerna f- (i storleksordningen 0,1 delar per miljon) som används i tandkött och munvatten har visat sig ha en djup positiv effekt på den förebyggande tandvård av karies.
 Kalciumfluor hjälper till att förebygga karies. Författare: Annalize Batista. Källa: Pixabay.
Kalciumfluor hjälper till att förebygga karies. Författare: Annalize Batista. Källa: Pixabay. CAF -nanopartiklar2 mer effektivt
Även om fluorider används i tandpasta och skölj, orsakar den låga koncentrationen av kalcium (CA) i saliv att kaffavlagringar inte bildas2 i tänderna på det mest effektiva sättet som möjligt.
Det är därför ett sätt att få kaffedamm har utformats2 Som nanopartiklar.
För detta används en torktumlare av Rocío (från engelska Spruttorkare) Där två lösningar (en av CA (OH) kalciumhydroxid2 och en av ammoniumfluorid NH4F) De blandas medan de sprayas i en kamera med varmluftflöde.
Då inträffar följande reaktion:
Ca (oh)2 + Nh4F → CAF2 (fast) + NH4Åh
Nh4Åh flyktiga som NH3 och h2O och CAF -nanopartiklarna kvarstår2.
Dessa har hög reaktivitet och större löslighet, vilket gör dem mer effektiva för seineralisering av tänder och som anticaries.
- I linsen för optisk utrustning
Kalciumfluorid används för att bygga optiska element såsom prismor och spektrofotometrar av infraröd och ultraviolett ljus (UV).
Dessa enheter tillåter att mäta mängden ljus som absorberas av ett material när det passerar genom det.
Kaf2 Det är transparent i dessa regioner i spektrumet av ljus, har ett extremt lågt brytningsindex och gör det möjligt att få en mer effektiv upplösning än för NaCl i intervallet 1500-4000 cm-1.
Kan tjäna dig: paramagnetismTack vare dess kemiska stabilitet kan stödja negativa förhållanden så att de optiska elementen i CAF2 De attackeras inte. Det har också en hög hårdhet.
I kameror
Vissa kameratillverkare använder kaffelinser2 Konstgjord kristalliserad för att minska lätt spridning och uppnå utmärkt korrigering av färger distorsion.
 Vissa kameror har CAF Calcium Fluoride -linser2 För att minska färger snedvridning. Bill Ebbesen [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)]. Källa: Wikimedia Commons.
Vissa kameror har CAF Calcium Fluoride -linser2 För att minska färger snedvridning. Bill Ebbesen [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)]. Källa: Wikimedia Commons. - I den metallurgiska industrin
Kaf2 Det används som ett grundande agent i den metallurgiska industrin, eftersom det är en källa till kalciumolöslig i vatten och därför effektivt i syrekänsliga applikationer.
Det används för att smälta och bearbeta järn och stål. Detta är baserat på det faktum att det har en smältpunkt som liknar järn och att den kan lösa oxider och metaller.
- I radioaktivitetsdetektorer eller farlig strålning
Kaf2 Det är ett termoluminescerande material. Detta innebär att den kan absorbera strålning i elektronerna i dess kristallina struktur och sedan när den värms upp för att frigöra den i form av ljus.
Detta utsända ljus kan mätas med en elektrisk signal. Denna signal är proportionell mot mängden strålning som mottagits av materialet. Betyder att ju större mängden strålning, desto större är mängden ljus som kommer att släppas ut senare när den upphettas.
Därför CAF2 Det används i de så kallade personliga tvåimetrarna, som används av människor som utsätts för farlig strålning och du vill veta hur mycket strålning de har fått under en tidsperiod.
- Andra användningsområden
- Det används som en katalysator i kemiska reaktioner av uttorkning och dehydrogenering för syntes av organiska föreningar.
- Det används i alkaliska svetsningselektroder. En starkare svetsning erhålls än med syraelektroder. Dessa elektroder är användbara vid tillverkning av fartyg och högtrycksstålbehållare.
- Som mattillskott i extremt låga mängder (ppm eller delar per miljon).
 Manssvetsning. Elektroder med kalciumfluoridkaffe2 De bildar starkare svetsar. William M. Tallrik jr. [Allmängods]. Källa: Wikimedia Commons.
Manssvetsning. Elektroder med kalciumfluoridkaffe2 De bildar starkare svetsar. William M. Tallrik jr. [Allmängods]. Källa: Wikimedia Commons. Referenser
- Pirmradian, m. och Hooshmand, T. (2019). Remineralisering och antibakteriell kapacitet hos hartsbaserade tandnanokompositer. Syntes och karakterisering av kalciumfluorid (CAF2). I tillämpningar av nanokompositmaterial i tandvård. Återhämtat sig från Scientedirect.com.
- ELLER.S. National Library of Medicine. (2019). Kalcium vid fluor. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Weman, K. (2012). Metallbågmanual (MMA) Svetsning med belagda elektroder. I Welding Processes Handbook (andra upplagan). Återhämtat sig från Scientedirect.com.
- Hanning, m. och Hanning, C. (2013). Nanobiomaterial i förebyggande tandvård. Nanosiserat fluorkalcium. I nanobiomaterial i klinisk tandvård. Återhämtat sig från Scientedirect.com.
- Ropp, r.C. (2013). Grupp 17 (H, F, CL, BR, I) Alkaliska jordföreningar. Kalcium vid fluor. I encyklopedi av de alkaliska jordföreningarna. Återhämtat sig från Scientedirect.com.
- Bomull, f. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- Valkovic, V. (2000). Mätningar av radioaktivitet. I radioaktivitet i miljön. Themoluminescent detektorer (TLDS). Återhämtat sig från Scientedirect.com.
- « Nitruro de Boro (BN) struktur, egenskaper, erhållning, användning
- Kiseloxid (SiO2) struktur, egenskaper, användningar, erhållning »

