Kalium yodato (kio3)
- 1753
- 532
- PhD. Lennart Johansson
Vad är kaliumjodat?
Kalium eller kalium yodato yodato är en oorganisk jodförening, särskilt ett salt, vars kemiska formel är kio3. Jod eller jod, element i halogruppen (F, Cl, BR, I, AS) har i detta salt ett oxidationsnummer +5; Det är därför det är ett starkt oxiderande medel. Kio3 Det dissocieras i vattenhaltigt medium för att skapa K -jonerna+ och io3-.
Det syntetiseras genom att reagera kaliumhydroxid med yodiumsyra: Hio3(aq) + koh (s) => kio3(aq) + h2Eller (l). Det kan också syntetiseras genom att reagera molekyljod med kaliumhydroxid: 3i2(S)+6KOH (S) => KIO3(aq) + 5ki (aq) + 3h2Eller (l).
Kalium yodato egenskaper
 Kalium yodato utseende
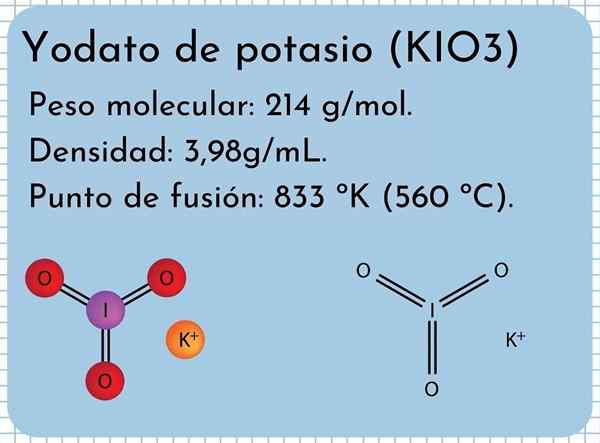
Kalium yodato utseende Det är en luktfri vit fast, fina kristaller och med en monoklinisk kristallin struktur. Den har en densitet på 3,98 g/ml, en molekylvikt av 214 g/mol och presenterar absorptionsband i det infraröda spektrumet (IR).
Den har en smältpunkt: 833 ºK (560 ºC), bestående av starka joniska interaktioner mellan K -joner+ och io3-. Vid högre temperaturer, en termisk sönderdelningsreaktion, frisläppande molekylärt syre och kaliumjodid:
2Kio3(S) => 2KI (S) + 3O2(g)
I vatten har det lösligheter som varierar från 4,74 g/100 ml till 0 ºC, upp till 32,3 g/100 ml vid 100 ºC, vilket genererar färglösa vattenlösningar. Dessutom är den olöslig i alkohol och salpetersyra, men den är löslig i utspädd svavelsyra.
Dess affinitet för vatten är inte märkbar, vilket förklarar varför det inte är hygroskopiskt och inte finns i form av hydratiserade salter (Kio3· H2ANTINGEN).
Oxiderande medel
Kalium Yodato, som indikeras av dess kemiska formel, har tre syreatomer. Detta är ett starkt elektronegativt element och på grund av den här egenskapen lämnar det "upptäckt" en elektronisk molnbrist som omger jodjod.
Kan tjäna dig: inerta gaserDenna brist - eller bidrag, i förekommande fall - kan beräknas som oxidationsnummer för jod (± 1, +2, +3, +5, +7), är +5 i fallet med detta salt.
Vad betyder det här? Att JOIN kommer att acceptera dem innan en art som kan ge sina elektroner (IO (IO3-) att bli molekylär jod och ha ett oxidationsnummer lika med 0.
Efter denna förklaring kan det fastställas att kaliumjodat är en oxiderande förening som reagerar intensivt med reducerande medel i många redoxreaktioner; Av alla dessa är en känd som en jodklocka.
Jodklockan består av en redoxprocess med långsamma och snabba steg, där de snabba stegen markeras av en KIO -lösning3 I svavelsyra till vilken stärkelse tillsätts. Sedan producerade och förankrade den stärkelse som producerades och förankrade bland sin struktur arten i3-- Det kommer att göra den färgglada blå lösningen till mörkblå.
Io3- + 3 hso3- → i- + 3 hso4-
Io3- + 5 i- + 6 h+ → 3 i2 + 3 h2ANTINGEN
Yo2 + Hso3- + H2O → 2 i- + Hso4- + 2 h+ (mörkblå på grund av stärkelsen)
Kemisk struktur
 Kalium yodato struktur
Kalium yodato struktur I den överlägsna bilden illustreras den kemiska strukturen för kaliumjodat. IO -anjonen3- Det representeras av "stativ" av röda och lila sfärer, medan K -jonerna+ De representeras av lila sfärer.
Men vad betyder dessa stativ? De korrekta geometriska formerna av dessa anjoner är faktiskt trigonala pyramider, där syre utgör den triangulära basen, och det icke-delade vridmomentet i jod pekar på övervåningen, ockuperar utrymme och tvingar att fälla ner I-O-länken och de två länkarna i = O = O.
Kan tjäna dig: TartarsyraDenna molekylära geometri motsvarar en SP -hybridisering3 av den centrala atomen i joden; Ett annat perspektiv antyder emellertid att en av syreatomerna bildar länkar till orbitalerna "D" av jod, faktiskt är en hybridisering av SP -typ3d2 (Jod kan ha sina "D" -banor som utvidgar sitt Valencia -lager).
Kristallerna i detta salt kan drabbas av strukturella fasövergångar (andra andra arrangemang än monoklin) som en följd av de olika fysiska förhållandena som utsätter dem.
Användning och tillämpningar av kaliumjodat
Terapeutisk användning
Kalium yodato används vanligtvis för att undvika ansamling av radioaktivitet i sköldkörteln i form av 131Jag, när denna isotop används för att bestämma jod av sköldkörteln som en del av driften av sköldkörteln.
Likaså används kalium yodato som ett aktuellt antiseptiskt (0,5 %) i slemhinnor.
Användning i branschen
Det läggs till maten hos avelsdjur som ett jodtillskott. Därför används kalium yodato i branschen för att förbättra mjölkvaliteten.
Analytisk
I analytisk kemi, tack vare dess stabilitet, används den som ett primärt mönster i standardiseringen av natriumtiosulfatmönster (NA2S2ANTINGEN3), i syfte att bestämma jodkoncentrationer i problemproblemen.
Detta innebär att jodmängder kan kännas med volymetriska tekniker (grader). I denna reaktion oxiderar kaliumjodat snabbt till jodidjonerna i-, Genom följande kemiska ekvation:
Kan tjäna dig: blyacetat: struktur, egenskaper, erhållning, användningIo3- + 5i- + 6h+ => 3i2 + 3 timmar2ANTINGEN
Jod, jag2, har titeln med NA -lösningen2S2ANTINGEN3 för sin standardisering.
Användning i laserteknik
Studier har visat och bekräftat de intressanta piezoelektriska, pyroelektriska, elektroopiska, ferroelektriska och icke -linjära optikegenskaperna för KIO Crystals3. Detta resulterar i stora potentialer inom det elektroniska området och i Lasers teknik för material som är gjorda med denna förening.
Hälsorisker för kaliumjodat
I höga doser kan det ge irritationer i oral slemhinnan, hud, ögon och luftvägar.
Experimenten av toxiciteten hos kaliumjodatet hos djur har gjort det möjligt för oss att observera att hos hundar i en snabb, vid doser av 0,2-0,25 g/kg kroppsvikt, levererat oralt, orsakar föreningen kräkningar.
Om dessa kräkningar undviks, producerar det hos djur en förvärring av deras situation, eftersom en anorexi och tidigare före döden induceras. Hans obduktioner fick observera nekrotiska leverskador, njurar och tarmslemhinnor.
På grund av dess oxiderande kraft utgör den en risk för eld när den kommer i kontakt med brandfarliga material.
Referenser
- Dag, r., & Underwood, a. Kvantitativ analytisk kemi (Femte ed.). Pearson Prentice Hall, P-364.
- Kemikaliebok. (2017). Kaliumjodat. Hämtad 25 mars 2018 från ChemicalBook: Chemicalbook.com
- Pub. (2018). Kaliumjodat. Hämtad 25 mars 2018 från PubChem: PubChem.Ncbi.Nlm.Nih.Gov
- Merck. (2018). Kalium yodato. Hämtad den 25 mars 2018 från Merck:
- Merckmillipore.com
- M M Abdel Kader et al. (2013). Ladda transportmekanism och övergångar med låg temperaturfas i Kio3. J. Fysik.: Conf. Vara. 423 012036

