Historikjod, egenskaper, struktur, erhållning, risker, användningar

- 912
- 64
- Karl Johansson
han jod Det är ett reaktivt icke -metalliskt element som tillhör grupp 17 i den periodiska tabellen (halogener) och representeras av den kemiska symbolen i. I huvudsak är det ett välkänt element på populärt nivå, från jodiserat vatten, till tyrosinhormonet.
I fast tillstånd är joden mörkgrå med en metallisk glans (nedre bild), som kan sublimera för att producera en violetta ånga som, när den kondenseras på en kall yta, lämnar en mörk rest. Många och attraktiva har varit experiment för att visa dessa egenskaper.
 Robusta jodkristaller. Källa: bungee [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]
Robusta jodkristaller. Källa: bungee [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] Detta element isolerades för första gången av Bernard Curtois år 1811, medan de erhöll föreningar som fungerade som råmaterial för tillverkning av saltpeter. Curtois identifierade emellertid inte jod som ett element, meriter delat av Joseph Gay-Lussac och Humphry Davy. Gay-Lussac identifierade elementet som "iode", en term som kom från det grekiska ordet "ioides" som den violetta färgen utsågs.
Elementär jod, som de andra halogenerna, är en diatomisk molekyl, bildad av två jodatomer förenade av en kovalent bindning. Van der Waals interaktion mellan jodmolekyler är den starkaste bland halogener. Detta förklarar varför jod är halogen med de högsta smält- och kokpunkterna. Dessutom är det det minsta reagenset av halogener och det med mindre elektronegativitet.
Jod är ett väsentligt element som kräver att man intas, eftersom det är nödvändigt för kroppstillväxt; hjärn- och mental utveckling; Metabolism i allmänhet, etc., Rekommenderar ett dagligt intag på 110 μg/dag.
Bristen på joden i en persons fostrets tillstånd är förknippat med utseendet på kretinism, ett tillstånd som kännetecknas av att bromsa kroppstillväxten; liksom otillräcklig mental och intellektuell utveckling, strabism, etc.
Samtidigt är en brist på jod i varje ålder av individen förknippad med utseendet på en stämpel, kännetecknad av en sköldkörtelhypertrofi. The Goiter är en endemisk sjukdom, eftersom den är begränsad till vissa geografiska områden med egna livsmedelsegenskaper.
[TOC]
Historia
Upptäckt
Joden upptäcktes av den franska kemisten Bernard Curtois, året 1811, medan han arbetade med sin far i produktionen av Salitre, vilket krävde natriumkarbonat.
Denna förening isolerades från tång som samlades på Normandiens kust och Brittany. För detta ändamål brände algerna och asken tvättades med vatten och förstörde det resulterande avfallet med tillsats av svavelsyra.
Vid ett tillfälle, kanske på grund av ett lyckligt fel, tilllade Curtois ett överskott av svavelsyra och en lila ånga bildades som kristalliserades på kalla ytor och avsatte sig som mörka kristaller. Curtois misstänkte att han var i närvaro av ett nytt element och kallade honom "substans X".
Curtois upptäckte att detta ämne när det blandades med ammoniak bildade ett brunt fast ämne (kväve triacuro) som utnyttjade minimal kontakt.
Curtois hade emellertid begränsningar för att fortsätta sin forskning och beslutade att leverera tecken på sitt ämne till Charles Desormes, Nicolas Clément, Joseph Gay-Lussac och André-Marie Ampère, för att få sitt samarbete.
Uppkomsten av namnet
I november 1813 offentliggjorde Desormes och Clément upptäckten av Curtois. I december samma år sa Gay-Lussac att det nya ämnet kan vara ett nytt element, vilket tyder på namnet "iode" från det grekiska ordet "ioides", avsett för violett.
Sir Humphry Davy, som fick en del av provet som levererades till Ampère av Curtois, gjorde experiment med provet och märkte en likhet med klor. I december 1813 deltog Royal Society of London identifiering av ett nytt element.
Även om ett argument mellan Gay-Lussac och Davy om identifiering av jod uppstod, insåg båda att curtois var den första som hade isolerat det. 1839 Curtois final.
Historiska användningar
1839 gav Louis Daguerre jod sitt första kommersiella användning, enligt uppfinningen av en metod för att producera fotografiska bilder som kallas daguerreotyper, i tunna metallark.
1905 undersökte den amerikanska patologen David Marine jodbrist vid vissa sjukdomar och rekommenderade hans intag.
Fysiska och kemiska egenskaper
Utseende
 Sublimering av jodkristaller. Källa: Ershova Elizaveta [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]
Sublimering av jodkristaller. Källa: Ershova Elizaveta [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] Mörkgrå metallisk lyster. När det sublimerar sina ångor är de violetta färg (överlägsen bild).
Standardatomvikt
126 904 U
Atomantal (z)
53
Smältpunkt
113,7 ºC
Kokpunkt
184.3 ºC
Densitet
Omgivningstemperatur: 4 933 g/cm3
Löslighet
I vattnet upplöses det för att orsaka bruna lösningar av en koncentration av 0,03% till 20 ºC.
Denna löslighet ökar avsevärt om det tidigare har upplösts jodidjoner, eftersom en balans mellan I är etablerad- och jag2 För att bilda den anjoniska arten i3-, som är löst bättre än jod.
I organiska lösningsmedel såsom kloroform, koltetraklorid och koldisulfid upplöses jod och ger en lila färg. Det upplöses också i kväveföreningar, såsom pyridin, kinolin och ammoniak, för att bilda en brun lösning igen.
Skillnaden i färg ligger i det faktum att jod löses som solvaterade molekyler i2, eller som belastning överför komplex; Det senare dyker upp när de handlar.
Kan tjäna dig: natriumsulfid (NA2S)Lukt
Tunnland, irriterande och karakteristisk. Lukttröskel: 90 mg/m3 och irriterande lukttröskel: 20 mg/m3.
Oktanol/vattenpartitionskoefficient
Log P = 2.49
Sönderfall
När han värms upp till sönderdelning avger han en vätejodidrök och flera jodidföreningar.
Gegga
2,27 CP vid 116 ºC
Trippelpunkt
386,65 K och 121 kPa
Kritisk punkt
819 K och 11,7 MPa
Fusionsvärme
15,52 kJ/mol
Förångningsvärme
41,57 kJ/mol
Molorisk kapacitet
54.44 J/(mol · k)
Ångtryck
Joden har ett måttligt ångtryck och när behållaren som innehåller öppnas, sublimeras den långsamt till en violett ånga, irriterande för ögon, näsa och hals.
Oxidationsnummer
Oxidationsnumren för jod är: -1 (i-), +1 (i+), +3 (i3+), +4 (i4+), +5 (i5+), +6 (i6+) och +7 (i7+). I alla jodidsalter, som fallet med KI, uppfyller joden ett oxidationsnummer -1, eftersom vi har anjon i-.
Jod förvärvar positiva oxidationsnummer i kombination med mer elektronegativa element än honom; Till exempel i sina oxider (i2ANTINGEN5 och jag4ANTINGEN9) eller interhalogenerade föreningar (I-F, I-CL och I-BR).
Elektronnegativitet
2.66 på Pauling -skalan
Joniseringsenergi
Först: 1.008,4 kJ/mol
Andra: 1.845 kJ/mol
Tredje: 3.180 kJ/mol
Värmeledningsförmåga
0,449 w/(m · k)
Elektrisk resistans
1,39 · 107 Ω · m till 0 ºC
Magnetisk ordning
Diamagnetisk
Reaktivitet
Jod kombineras med de flesta metaller för att bilda jodider, och även med icke -metalliska element som fosfor och andra halogener. Jodidjonen är ett starkt reducerande medel, som spontant släpper ut en elektron. Jodidoxidation ger ett brunt färgämne av jod.
Jod, tvärtom av jodid, är ett svagt oxidationsmedel; svagare än brom, klor och fluorid.
Jod med oxidationsnummer +1 kan kombineras med andra halogener med oxidationsnummer -1, för att komma från jodens halider; Till exempel: Jodbromid. Det kombineras också med väte för att orsaka vätejodid, som efter att ha upplöses i vatten kallas iarhydinsyra.
Yodhorrinsyra är en mycket stark syra som kan bilda jodider genom reaktion med metaller eller deras oxider, hydroxider och karbonater. Jod har ett oxidationstillstånd +5 i yodiumsyra (Hio3), som är uttorkad för att producera jodpentoxid (i2ANTINGEN5).
Elektronisk struktur och konfiguration
- Jodatom och deras länkar
 Joddiatomisk molekyl. Källa: Benjah-Bmm27 via Wikipedia.
Joddiatomisk molekyl. Källa: Benjah-Bmm27 via Wikipedia. Joden i sitt basaltillstånd består av en atom som har sju elektroner i Valencia, bara en av att kunna slutföra sin oktett och bli isolektronisk med ädla xenongas. Dessa sju elektroner är arrangerade i deras 5 -tals- och 5p -orbitaler enligt deras elektroniska konfiguration:
[KR] 4d10 5S2 5 p5
Därför visar atomer jag en stark tendens att koppla kovalent så att var och en individuellt har åtta elektroner i sitt yttersta lager. Således närmar sig två atomer jag närmar sig I-I-länken, som definierar diatomisk molekyl I2 (överlägsen bild); Molekylär jodenhet i dess tre fysiska tillstånd under normala förhållanden.
I bilden observeras molekylen I2 representerad av en rymdfyllningsmodell. Det är inte bara en diatomisk molekyl, utan också homonukleär och apolär; Så dess intermolekylära interaktioner (i2 - Yo2) De styrs av London -spridningskrafter, som är direkt proportionella mot deras molekylmassa och atomstorlek.
Denna I-I-länk är emellertid svagare jämfört med den för de andra halogenerna (F-F, CL-CL och BR-BR). Detta beror i teorin på den dåliga överlappningen av dess spo3.
- Kristaller
Molekylmassan för I2 Det gör att dess spridande krafter kan vara tillräckligt riktade och starka för att etablera ett ortorrombiskt glas vid omgivningstryck. Dess höga elektroninnehåll gör att ljus främjar energiövergångssymfiner, som producerar jodkristaller.
Men när jod sublimerar sina ångor uppvisar en violetta färg. Detta är redan en indikation på en mer specifik övergång inom de molekylära orbitalerna i i2 (De med större energi eller antienlace).
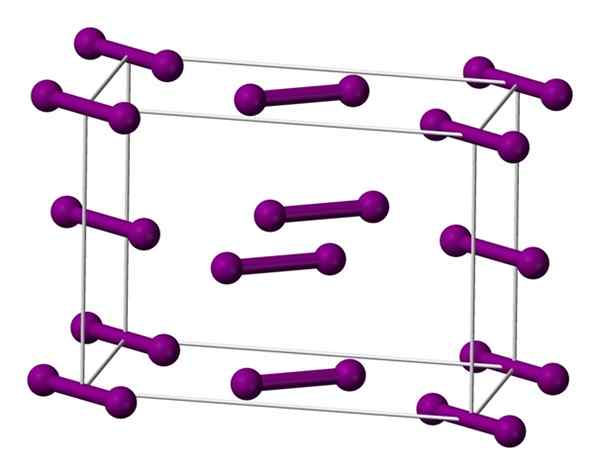 Enhet ortorrombisk cell centrerad på basen för jodkristall. Källa: Benjah-Bmm27 [Public Domain].
Enhet ortorrombisk cell centrerad på basen för jodkristall. Källa: Benjah-Bmm27 [Public Domain]. Molekylerna jag visas ovan2, representerad av en modell av sfärer och staplar, beställd inuti den ortorrombiska cellen.
Det kan observeras att det finns två lager: det för nedan med fem molekyler och det för mediet med fyra. Observera att en jodmolekyl är belägen vid basen av cellen. Kristallen konstrueras regelbundet dessa lager i de tre dimensionerna.
Turnera riktningen parallell med I-I-länkarna, har det visat sig att jod orbitaler överlappar varandra för att generera ett drivande band, som återgår till detta element en halvledare; Emellertid försvinner dess förmåga att genomföra el om riktningen vinkelrätt mot skikten följs.
Länkavstånd
I-I-länken verkar ha varit försenad; Och i själva verket är det, eftersom längden på länken ökar från 266 pm (gasformigt tillstånd), 272 PM (fast tillstånd).
Detta kan bero på det faktum att i gasen är molekylerna i2 De är mycket distanserade, deras intermolekylära krafter är nästan försumbara; Medan de är i de fasta ämnena blir dessa krafter (I-I-I-I) konkreta och lockar jodatomerna hos två angränsande molekyler mot sig själva och enligt det intermolekylära avståndet (eller interatomiskt, annars sett).
Det kan tjäna dig: kemiförhållande med andra vetenskaperSedan, när det sublimala jodglaset, kontrakt I-I-bindningen i gasfasen, eftersom angränsande molekyler inte längre utövar samma attraktionskraft (spridande) över omgivningen. Och också logiskt avståndet i2 - Yo2 ökning.
- Faser
Det nämndes ovan att I-I-länken är svagare jämfört med den för de andra halogenerna. I gasfas vid en temperatur av 575 ºC, 1% av molekylerna i2 De sönderdelas till individuella och atomer. Det finns så mycket termisk energi att bara två och återhoppar är separerade, och så vidare.
På liknande sätt kan denna länkbrytning inträffa om enorma tryck på jodkristaller appliceras. När du komprimerar det för mycket (under tryck hundratusentals gånger högre än atmosfäriskt), molekylerna i2 De omorganiseras som en monoatomisk fas I, och det sägs då att jod uppvisar metallegenskaper.
Det finns emellertid andra kristallina faser, såsom: kroppscenterad ortom.
Var är det och få
Jod har en viktandel, i förhållande till jordskorpan, 0,46 ppm, ockupera plats 61 i överflöd i den. Yoduro -mineraler är knappa, och jodavlagringar som är kommersiellt exploaterbara är Yodatos.
Jodmineraler hittar i stolliga bergarter med en koncentration av 0,02 mg/kg vid 1,2 mg/kg och i magmatiska bergarter med en koncentration av 0,02 mg vid 1,9 mg/kg. Det finns också i Kimmeridge Lutita, med en koncentration av 17 mg/kg vikt.
Dessutom finns jodmineraler i fosfatbergarter med en koncentration mellan 0,8 och 130 mg/kg. Havsvatten har en jodkoncentration som varierar från 0,1 till 18 ug/L. Alger, svampar och marina ostron var tidigare de viktigaste källorna till jod.
Emellertid är de viktigaste källorna caliche, natriumnitratavlagringar i Atacama -öknen (Chile), och Salmuelas, främst de i det japanska gasfältet i Minami Kanto, öster om Tokyo, och Anadarko -fältbassängen i Oklahoma (USA ).
Kalchen
Jod extraheras från jodinus caliche och behandlas med natriumbisulfit för att reducera den till jodid. Sedan reagerar lösningen med nyligen extraherad Yodato för att underlätta dess filtrering. Caliche var den viktigaste källan till jod under det nittonde och tidiga tjugonde århundradet.
Saltlaken
Efter rening behandlas saltlösningen med svavelsyra, som producerar jodid.
Denna jodidlösning reagerar därefter med klor för att producera en utspädd jodlösning, som avdunstar med hjälp av en luftström som avviker till ett absorberande torn av svaveldioxid, vilket ger följande reaktion:
Yo2 + 2 h2Eller +så2 => 2 hi +h2Sw4
Därefter reagerar vätejodidgas med klor för att frigöra jod i ett gasformigt tillstånd:
2 hej +cl2 => I2 + 2 hcl
Och slutligen, jodfilter, rena och förpackningar för användning.
Biologiskt papper
- Rekommenderad diet
Jod är ett väsentligt element, eftersom det ingriper i många funktioner i levande varelser, som är särskilt kända hos människor. Det enda sättet att inträde av jod till människan är de livsmedel som han intar.
Den rekommenderade joddieten varierar med åldern. Således kräver en 6 -månaders pojke ett intag på 110 ug/dag; Men från 14 års ålder är den rekommenderade dieten 150 ug/dag. Dessutom noteras att jodintaget inte bör överstiga 1.100 ug/dag.
- Sköldkörtelhormoner
Sköldkörtelstimulerande hormon (TSH) utsöndras av hypofysen och stimulerar jod med sköldkörtelfolliklar. JOD bärs inuti sköldkörtelfolliklarna, känd som kolloider, där den binder till aminosyran för att bilda monoyodothyrosin och diiodothyrosin.
I follikulär kolloid, ett monoyodirosin3). Å andra sidan kan två diiodothyrosinmolekyler förenas och bilda tetraryDotyron (T4). T3 och t4 De är de så kallade sköldkörtelhormonerna.
Hormoner t3 och t4 De utsöndras till plasma där de binder till plasmaproteiner; Bland dem transportproteinet från sköldkörtelhormoner (TBG). De flesta sköldkörtelhormoner transporteras i plasma som T4.
Men den aktiva formen av sköldkörtelhormoner är t3, Så T4 I de "vita organen" av sköldkörtelhormoner, erfarenheter och förvandlas till T3 För att utöva din hormonella åtgärd.
Effekter
Effekterna av verkan av sköldkörtelhormoner är flera, och kan påpeka följande: ökning av metabolism och proteinsyntes; främjande av kroppstillväxt och hjärnutveckling; Ökat blodtryck och hjärtfrekvens etc.
- Brist
Bristen på jod och därför av sköldkörtelhormoner, känd som hypotyreos, har många konsekvenser som påverkas av personens ålder.
Om jodbrist inträffar under en persons fosterstat är den mest relevanta konsekvensen kreatinism. Detta tillstånd kännetecknas av tecken som försämring av mental funktion, försening i fysisk utveckling, strudism och sen sexuell mognad.
Kan tjäna dig: koppar: historia, egenskaper, struktur, användningsområden, biologiskt papperEn jodbrist kan inducera en stång, oavsett ålder vid vilken brist inträffar. En stång är en överdriven sköldkörtelutveckling, orsakad av överdriven stimulering av körtlarna av TSH -hormonet, frisatt från hypofysen som en följd av jodbrist.
Den överdrivna storleken på sköldkörteln (struten) kan komprimera luftstrupen och begränsa luftens passage genom den. Dessutom kan det orsaka skador på laryngeala nerver som kan ha som ett resultat rom.
Risker
En förgiftning på grund av överdrivet jodintag kan orsaka brännskador i munnen, halsen och febern. Även buksmärta, illamående, kräkningar, diarré, svag puls och koma.
Ett överskott av jod producerar några av de symtom som observerats i en brist: det finns en hämning av syntesen av sköldkörtelhormoner, så frisättningen av TSH ökar, vilket resulterar i en sköldkörtelhypertrofi; det vill säga en stång.
Det finns studier som indikerar att överdrivet jodintag kan orsaka papillär cancer i sköldkörteln. Dessutom kan överdrivet jodintag interagera med mediciner genom att begränsa dess verkan.
Överdriven jodintag med antityreoidläkemedel, såsom metimazol, som används för att behandla hypertyreos, kan ha en tillsatseffekt och orsaka hypotyreos.
Angiotensin (ECA) -konvertering av enzymhämmare, såsom benazepril, används vid hypertonibehandling. Att ta en överdriven mängd kaliumjodid ökar risken för hyperkalemi och hypertoni.
Ansökningar
Läkare
Jod fungerar som ett desinfektionsmedel av hud eller sår. Den har nästan ögonblicksbild antimikrobiell verkan, penetrerar mikroorganismerna och interagerar med svavelaminosyror, nukleotider och fettsyror, vilket orsakar celldöd.
Den utövar sin antivirala verkan i grunden på de täckta virusen och postulerar som attackerar ytan på de täckta virusen.
Kaliumjodid i koncentrerad lösning används vid behandling av tyrotoxikos. Det används också för att kontrollera effekterna av en strålning av 131Jag när jag blockerar föreningen av den radioaktiva isotopen till sköldkörteln.
Jod används vid behandling av dendritisk keratit. För detta utsätts hornhinnan till ångor av mättat vatten med jod, epitelet i hornhinnan tillfälligt förlorar; Men det finns en fullständig återhämtning av det på två eller tre dagar.
Jod har också gynnsamma effekter på behandlingen av mänsklig sinusfibros. På samma sätt har det påpekats att 131Jag kan vara en valfri sköldkörtelcancerbehandling.
Reaktioner och katalytisk verkan
Jod används för att upptäcka närvaron av stärkelse, vilket ger en blå färg. Reaktionen av joden med stärkelse används också för att upptäcka närvaron av falska biljetter tryckt på papper som innehåller stärkelse.
Kalium (ii) TetrayodomerCurate, även känd som Nessler Reagent, används vid ammoniakdetektering. Likaså används en alkalisk jodlösning i jodformtestet för att visa närvaron av metylcetonous.
Oorganisk jodid. I ett skede av processen måste tetrayoduro för dessa metaller bildas.
Jod fungerar som en stabilisator för Colfonia, olja och andra träprodukter.
Jod används som en katalysator vid organiska syntesreaktioner av metylering, isomerisering och dehydrogenering. Samtidigt används iarklorsyra som en katalysator för produktion av ättiksyra i Monsanto- och Cativa -processerna.
Jod fungerar som en katalysator i kondensation och alposation av aromatiska aminer, liksom i sulfatiserings- och sulfanationsprocesser, och för produktion av syntetiska gummi.
Fotografering och optik
Silver Yoduro är en viktig del av den traditionella fotografiska filmen. Jod används vid tillverkning av elektroniska instrument som unika glasprismor, polariserande optiska instrument och ett glas som kan överföra infraröda strålar.
Andra användningsområden
Jod används vid utarbetande av bekämpningsmedel, anilin och phtaleína färgämnen. Dessutom används den i färgämnen och är ett röksläckningsmedel. Och slutligen fungerar silverjodid som en kärna av kondensation av vattenånga i molnen för att orsaka regn.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Stuart Ira Fox. (2003). Mänsklig psykologi. Första upplagan. Redigera. McGraw-Hill Inter-American
- Wikipedia. (2019). Jod. Hämtad från: i.Wikipedia.org
- Takemura Kenichi, Sato Kyoko, Fujihisa Hiroshi & Onoda Mitsuko. (2003). Modulerad struptering av fast jod under STI -molekylär dissociation och. Naturvolym 423, sidor971-974. doi.org/10.1038/natur01724
- Chen l. et al. (1994). Strukturella fasövergångar av jod vid högt tryck. Institute of Physics, Sinica Academy, Peking. doi.org/10.1088/0256-307X/11/2/010
- Stefan Schneider & Karl Christe. (26 augusti 2019). Jod. Encyclopædia Britannica. Återhämtat sig från: Britannica.com
- Doktor. Doug Stewart. (2019). Jodelement fakta. Kemikkolis. Återhämtat sig från: Chemicool.com
- Nationellt centrum för bioteknikinformation. (2019). Jod. Pubchemdatabas. Cid = 807. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Rohner, f., Zimmermann, m., Jooste, s., Pandav, c., Caldwell, K., Raghavan, r., & Raiten, D. J. (2014). Biomarkörer för näring för utveckling-jodgranskning. Journal of Nutrition, 144 (8), 1322S-1342S. Doi: 10.3945/jn.113.181974
- Hov. (2019). Jod. Kemi förklarade. Återhämtat sig från: kemi.com
- Traci Pedersen. (19 april 2017). Fakta om jod. Återhämtat sig från: Livescience.com
- Megan Ware, Rdn, LD. (30 maj 2017). Allt du behöver veta om jod. Återställt från: MedicalNewStody.com
- National Institute of Health. (9 juli 2019). Jod. Hämtad från: SDG.Va.Nih.Gov
- « Kripton historia, egenskaper, struktur, erhållning, risker, användningar
- Mary Celeste antecedents, evenemang, teorier »

