Blyjodidstruktur, egenskaper, erhållning, användningar

- 1598
- 50
- Prof. Erik Johansson
han Blyjodid Det är en oorganisk förening som bildas av blyelementet (PB) i sin oxidation +2 och jod (i) med Valencia -1. Dess kemiska formel är BNP2. Det är en giftig förening. Eftersom det leder är skadligt för människan, djur och naturliga ekosystem. Dessutom kan jodid också orsaka vissa sjukdomar.
BNP -föreningen4, Detta är, med bly i oxidation +4, verkar det som om det inte finns, förmodligen på grund av jodidjonens reducerande kapacitet (i-). BNP2 Det är en solid gul färg som är lite löslig i vatten.
 Blyjodid (BNP2) fast. W. Oelen/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0). Källa: Wikimedia Commons.
Blyjodid (BNP2) fast. W. Oelen/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0). Källa: Wikimedia Commons. Det kan erhållas med hjälp av en jonbytesreaktion mellan ett jodidsalt och en ledning som båda är lösliga i vatten.
Den har halvledaregenskaper, så de flesta av dess nuvarande applikationer finns i fotovoltaiska enheter, detektorer av viss strålning och sensorer.
En av de mest studerade användningarna av denna förening är den av Perovskita solceller, som har visat sig vara mycket effektiva och låga kostnader.
[TOC]
Strukturera
I blyjodid är föreningen mellan dess atomer endast jonisk. Atomer bildar lager med hexagonal struktur och de är kopplade till varandra genom svaga krafter från van der Waals.
Dessa krafter är varken joniska eller kovalenta, är svaga interaktioner mellan de elektroniska skikten av atomer.
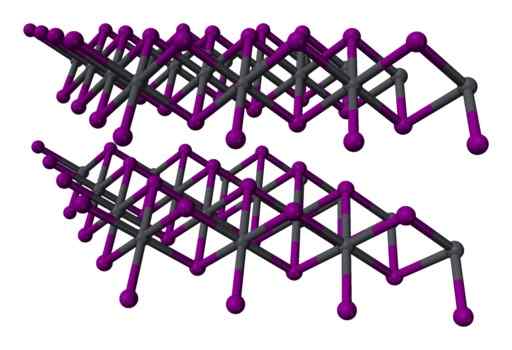 Två -skikt tre -skiktstruktur2 kristall-. Grå = bly; Violet = jod. Benjah-Bmm27 / allmän domän. Källa: Wikimedia Commons.
Två -skikt tre -skiktstruktur2 kristall-. Grå = bly; Violet = jod. Benjah-Bmm27 / allmän domän. Källa: Wikimedia Commons. Nomenklatur
- Blyjodid
- Blyjodid (ii)
- Blygdioduro
- Plumbosjodid
Egenskaper
Fysiskt tillstånd
Ljusgul kristallint fast. Hexagonala kristaller.
 Hexagonala kristaller av blyjodid. Alessandro E Damiano/CC av (https: // CreativeCommons.Org/licenser/av/4.0). Källa: Wikimedia Commons.
Hexagonala kristaller av blyjodid. Alessandro E Damiano/CC av (https: // CreativeCommons.Org/licenser/av/4.0). Källa: Wikimedia Commons. Molekylvikt
461 g/mol
Smältpunkt
410 ºC
Kokpunkt
954 ° C, koka med nedbrytning.
Densitet
6.16 g/cm3
Löslighet
Lätt vattenlöslig: 0,076 g/100 ml vid 25 ° C. Varmvattenlösligt. Olöslig i alkohol och kall saltsyra (HCL).
Kan tjäna dig: natrium: historia, struktur, egenskaper, risker och användningarKemiska egenskaper
Dess oxiderande och reducerande egenskaper är svaga. Du kan dock presentera oxidenuktionsreaktioner.
Även om det är väldigt lite lösligt i vatten upplöses i koncentrerade lösningar av alkaliska jodider såsom kaliumjodid (KI). Det är lösligt i koncentrerad lösning av natriumacetat (CH3Ficka). Det löses fritt i natriumtiosulfatlösning (NA2S2ANTINGEN3).
Vissa författare indikerar att i vatten kan jon PBI genereras+ Och om det finns överskott av jon (i-) mer komplexa arter som BNP kan bildas3- och BNP42-, bland annat.
Det är inte brandfarligt.
Andra fysiska egenskaper
Det uppträder som en halvledare, det vill säga att den kanske eller inte kan utföra el beroende på de förhållanden som den utsätts för.
Det är en direkt Gap Semiconductor, det vill säga för att en av dess elektroner passerar från Valencia -bandet till körning, måste det bara ha en mängd energi som är lika med den förbjudna bandbredden.
På grund av det höga atomantalet för dess element (PB = 82, i = 53) har det en hög fotoelektrisk kapacitet. Dess 2,5 Gap Band tillåter högeffektiva fotovoltaiska prestationer vid temperaturer upp till 250 ° C.
Erhållande
Det kan framställas genom att reagera en vattenlöslig förening med iarhydinsyra (HI) eller med en löslig metalljodid. Till exempel blandas en vattenlösning av blyacetat med kaliumjodid:
Pb (ch3Kuttra)2 + 2 ki → BNP2↓ + 2 K (välj3Kuttra)
Denna typ av reaktion kallas "jonbyte" eftersom katjoner och anjoner utbyts mellan salter.
I det nämnda exemplet är kaliumacetat mycket lösligt i vatten och förblir upplöst, medan kaliumjodid, är mindre löslig, fällning och filter. Rening görs genom omkristallisering av föreningen i vatten.
Kan tjäna dig: kristallisationPBI -nederbörd2 Det kan ses i följande bild som visar ett provrör där blynitrat (II) (PB (Nej3)2) och kaliumjodid (KI) i vattenlösning. Denna effekt kallas "guld av guld".
 Regn av guld från BNP2. Stefano SCT/CC BY-S (https: // Creativecommons.Org/licenser/BY-SA/4.0). Källa: Wikimedia Commons.
Regn av guld från BNP2. Stefano SCT/CC BY-S (https: // Creativecommons.Org/licenser/BY-SA/4.0). Källa: Wikimedia Commons. Ansökningar
Som halvledare
Det används som en detektor för fotoner med hög energi som X -RAYS och GAMMA -strålar. Det kan användas i fotovoltaiska enheter, fotoceller, LED -lampor, optiska detektorer och i biologisk klassificering och sensorer.
Om den introduceras i nanostrukturer kan den användas vid fotokatalys och solceller. Dessutom många BNP -nanopartiklar2 De har självlysande egenskaper.
 Blyjodid används i x -ray medicinska detektorer. Författare: lkcjjang40090. Källa: Pixabay.
Blyjodid används i x -ray medicinska detektorer. Författare: lkcjjang40090. Källa: Pixabay. Solceller
BNP2 Det är en mellanhand i syntesen av perovskitas avsedd för solceller. Denna typ av fotovoltaiska celler innehåller metylammonium och blyjodid (välj3Nh3Bal3) På grund av farbror2.
Sådana enheter har hög effektivitet och låg kostnad, så de har varit mycket studier och forskning.
 Solceller på taket på ett hus i fältet. Solcellerna där PBI används2 De är mycket effektiva och är inte särskilt dyra, så de kan användas i hus i framtiden. Författare: Manfred Antranias Zimmer. Källa: Pixabay.
Solceller på taket på ett hus i fältet. Solcellerna där PBI används2 De är mycket effektiva och är inte särskilt dyra, så de kan användas i hus i framtiden. Författare: Manfred Antranias Zimmer. Källa: Pixabay. Men sedan Cho3Nh3Bal3 Det kan bryta ner med regnvatten, det har studerats hur förorenande dessa celler kan vara både när de används och när de kasseras.
Ch3Nh3Bal3 Vid kontakt med vatten bryts det in i metylamin (välj3Nh2), Yodhydronsyra och BNP2. Det senare, även om det är lite lösligt i vatten, kan med tiden släppa mängder från den toxiska jon PB2+.
Studierna är inte avgörande, eftersom platsen där blyutsläpp inträffar för att avgöra om beloppet kan vara skadligt på kort sikt. Å andra sidan kan en fortsatt utgåva bioackumulera och vara mycket farligt.
Kan tjäna dig: Butanone: Struktur, egenskaper och användningarAndra appar
- Det sås i form av spray i molnen för att producera regn.
- I filter för astronomi av den avlägsna infraröd.
- I fotografering, intryck, filmer för att spela in optiska bilder, fotografiska emulsioner.
- I bromsbeläggning. I smörjfetter.
- Kvicksilver ångbågslampor. På elektrisk papper.
- Termoelektriska material, termiska batterier med jod.
Risker
För säkerhet
Det måste förvaras långt ifrån oxidanter som peroxider, peroxider, permanganater, klorer och nitrater. Kontakt med kemiskt aktiva metaller som kalium, natrium, magnesium och zink bör också undvikas. I alla dessa fall kan en våldsam reaktion uppstå.
Om du genomgår uppvärmning genereras giftiga blygaser och jod.
För hälsan
Är mycket skadligt för människan. Det har bekräftats att det är cancerframkallande för djur, därför dras det rimligt att det också är för människan.
Det kan orsaka huvudvärk, irritabilitet, minska minnet och störa sömn. Bly som finns i denna förening kan generera permanent skada på njurar, hjärna, nerver, blodceller och högtrycksrisk.
Det måste hanteras som en teratogen (förening som kan generera en medfödd defekt). Det kan också producera jod, vars symtom är överbelastning av näsborrar, huvudvärk, irritation av slemhinnor och kutanutbrott, bland andra.
För den naturliga miljön
Det klassificeras som toxiskt förorenande medel. Det måste hållas borta från vatten och dränera källor. För att undvika förorenande dikar bör byggas när det är nödvändigt att behålla det.
Det är mycket giftigt för vattenlevande liv med effekter som varar över tiden, eftersom det är bioakumulerbart.
Referenser
- Bly, D.R. (redaktör) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- ELLER.S. National Library of Medicine. (2019). Blyjodid. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Bomull, f. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- Evstropiev; S.K. et al. (2020). Syntes och karakterisering av PVP/PBI2. Adv Compos Hybrid Mater 3, 49-57 (2020). Länk återhämtat sig.Kandare.com.
- Ismail, r.TILL. et al. (2016). Syntes av PBI2 Nanopartiklar genom laserablation i metanol. J Mater Sci: Mater Electron 27, 10696-10700 (2016). Länk återhämtat sig.Kandare.com.
- Materiel. (2013). Blyjodid (BNP2) Halvledare. Återhämtat sig från azom.com.
- CDH (2008). Bly (ii) jodid. Säkerhetsdatablad. Återhämtat sig från Chdfinechemical.com.
- Hailegnaw, f. et al. (2015). Regn på metylammonium blyjodidbaserade perovskiter: möjliga miljöeffekter av perovskit solceller. J. Fysik. Kem. Lett. 2015, 6, 9, 1543-1547. Återhämtat sig från pubar.ACS.org.
- Wikimedia Foundation (2020). Bly (ii) jodid. Hämtas från.Wikipedia.org.
- « Blyacetatstruktur, egenskaper, erhållning, användning
- Organisation av ett objektivt företag, struktur, exempel »

