Aktinegenskaper, struktur, filament, funktion
- 4232
- 445
- Per Karlsson
De Aktin Det är ett cytosoliskt protein som bildar mikrofilament. I eukaryoter är aktin ett av de vanligaste proteinerna. Till exempel representerar det 10 viktprocent av det totala proteinet i muskelceller; och mellan 1 och 5% av proteinet i icke -muskelceller.
Detta protein, bredvid mellanliggande filament och mikrotubuli, bildar cytoskeletten, vars huvudfunktion är mobiliteten i cellen, upprätthållandet av cellform, celldelning och rörelse av organeller i växter, svampar och djur.
 Källa: Sarcomere.SVG: David Richfield (Slashme-användare) Derivatarbete: Retama [CC BY-SA 3.0 (http: // Creativecommons.Org/licenser/BY-SA/3.0/]]
Källa: Sarcomere.SVG: David Richfield (Slashme-användare) Derivatarbete: Retama [CC BY-SA 3.0 (http: // Creativecommons.Org/licenser/BY-SA/3.0/]] Isoformer av aktincytoskelet.
Ur evolutionär synvinkel är Actin ett mycket bevarat protein. Det finns cirka 90% sekvenshomologi i olika arter. I encelliga organismer kodar en enda gen en aktin Isaform. Medan de är i multicellulära organismer kodar olika gener flera aktin Isaforms.
Aktinen, tillsammans med myosin, var avgörande strukturer i den evolutionära framtiden för eukaryota organismer och deras diversifiering, eftersom de tillät rörelse i frånvaro av andra strukturer, såsom flagella och cilia.
[TOC]
Struktur: aktinfilament
Actin är ett enda polypeptidkedjeklöksprotein. I muskeln har aktinen en molekylmassa på cirka 42 kDa.
Detta protein har två domäner. Var och en har två underdomäner och en klyftan mellan domänerna. ATP-MG+2 går med i botten av klyftan. Amino- och karboxilterminalerna samlas i underdomän 1.
Actina G och Actina f
Det finns två huvudsakliga aktinformer: Actin -monomeren, kallad Actina G; och en filamentös polymer, bestående av aktin G -monomerer, kallad Actina F. Aktinfilament, observerade genom elektronisk mikroskopi, har smala respektive breda regioner 7 nm respektive 9 nm i diameter.
I hela glödtråden bildar aktinmonomerer en dubbel spiral pressad. En enhet som upprepas i hela glödtråden består av 13 propeller och 28 aktinmonomerer och har ett avstånd på 72 nm.
Actin -filamentet har två ändar. Man bildar klyftan som ansluter ATP-MG+2, som är belägen i samma riktning i alla aktinmonomerer i filamentet, kallad slutet (-); Och den andra änden är motsatsen, kallad slutet (+). Därför sägs det att aktinfilamentet har polaritet.
Många gånger är dessa komponenter kända som mikrofilament, eftersom de är komponenterna i cytoskeletten som presenterar mindre diameter.
Var hittar vi aktin?
Actin är ett extremt vanligt protein i eukaryota organismer. Av alla cellproteiner representerar aktin cirka 5 till 10% - beroende på celltyp. I levern, till exempel, var och en av cellerna som utgör den nästan 5.108 Aktinmolekyler.
Egenskaper
De två formerna av aktin, monomer och filament finns kontinuerligt i en dynamisk balans mellan polymerisation och depolymerer. I allmänhet finns det tre funktioner i detta fenomen:
1) Aktinfilament är typiska för strukturen i muskelvävnad och cytoskelett i eukaryota celler.
Kan tjäna dig: de 10 egenskaperna hos de mest framstående lipiderna2) Polymerisation och depolimerisering är en dynamisk process som regleras. Där polymerisationen eller aggregeringen av G-ATP-MG-aktinmonomerer+2 Det händer i båda ändarna. Att denna process inträffar beror på mediet och de reglerande proteinerna.
3) Bildningen av strålar och retiklar, som utgör aktincytoskelett, ger kraft till cellmotilitet. Detta beror på proteiner som deltar i bildningen av tvärbindningar.
Funktioner
Muskelsammandragning
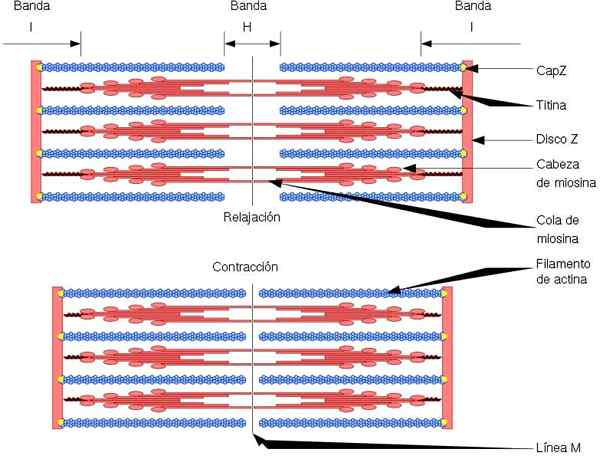
Den funktionella och strukturella enheten i skelettmuskeln är sarkomaren, som har två typer av filament: tunna filament, bildade av aktin och tjocka filament, bildade av myosin. Båda filamenten är organiserade växelvis på ett exakt geometriskt sätt. Tillåt muskelkontraktion.
Tunna filament är förankrade till regioner som kallas skivor z. Denna region består av ett fibernätverk, där CAPZ -proteinet är beläget, och till vilket ändarna (+) av aktinfilament är förankrade. Detta ankare förhindrar slut depolerisering (+).
Å andra sidan, i ändarna (-) av aktinfilament, är tropomodulin beläget och skyddar dem från depolymersion. Förutom aktin har tunna filament tropomiosin och troponin, som har funktionen att kontrollera aktomiosininteraktioner.
Hur inträffar muskelkontraktion?
Under muskelkontraktion gör tjocka filament pivotrörelser och drar de tunna filamenten mot mitten av sarkomin. Detta ger glidningen av de tjocka och tunna fibrerna.
Således förblir längden på de tjocka och tunna filamenten konstant, men ökar överlappningen mellan båda filamenten. Sarkomers längd minskar genom förankring av tunna filament till Z -skivorna.
Hur stoppar muskelkontraktionen?
ATP är cellens energiburuta. Därför är det nästan alltid tillgängligt i levande muskelvävnader. Med hänsyn till ovanstående måste det finnas mekanismer som tillåter muskelavslappning och gripandet av sammandragningar.
Två proteiner, kallad tropomiosin och troponin, har en grundläggande roll i detta fenomen. Dessa arbetar tillsammans för att blockera unionens platser i myosin (därmed förhindra deras förening med Actin). Som ett resultat slappnar muskeln.
Till skillnad från, när ett djur dör upplever ett fenomen som kallas Mortis Rigor. Den person som är ansvarig för denna härdning av kroppen är blockaden av interaktionen mellan myosin och aktin, strax efter djurets död.
En av konsekvenserna av detta fenomen är behovet av ATP för frisättning av de två proteinmolekylerna. Logiskt sett finns det ingen ATP -tillgänglighet i döda tyger och denna utgåva kan inte inträffa.
Andra typer av rörelser
Samma mekanism som vi beskriver (senare kommer vi att fördjupa mekanismen som ligger till grund för rörelse) är inte begränsad till djurens muskelkontraktioner. Han är ansvarig för de ameboidala rörelserna som vi observerar i amoebas och i vissa kolonialformar.
På samma sätt leds den cytoplasmiska rörelsen som vi observerar i alger och landväxter av liknande mekanismer.
Reglering av polymerisation och depolymerisation av aktintråd
Kontraktionen av glatt muskelvävnad och celler ger en aktin F -ökning och en minskning av aktin G. Aktinpolymerisation förekommer i tre steg: 1) kärnbildning, ett långsamt steg; 2) förlängning, ett snabbt steg; och 3) stabil status. Polymerisationshastigheten är lika med depolymerisationshastigheten.
Kan tjäna dig: fixistteori: koncept, postulat och författareActin-filamentet växer snabbare i slutet (+) än slutet (-). Förlängningshastigheten är proportionell mot koncentrationen av aktinmonomerer i jämvikt med aktinfilament, kallad kritisk koncentration (CC).
CC för slutet (+) är 0,1 um och för slutet (-) är 0,8 um. Detta innebär att 8 gånger mindre koncentration av aktinmonomerer krävs för att polymerisera slutet (+).
Actin -polymerisation regleras huvudsakligen av beta4 -bedrägerier (TB4). Detta protein förenar aktin G och behåller den och förhindrar polymerice. Medan propylin stimulerar aktinpolymerisation. Profil binder till aktinmonomerer som underlättar polymerisation i slutet (+), genom dissociation av aktin-TB4-komplexet.
Andra faktorer som jonökning (NA+, K+ eller mg+2) gynna bildandet av filament.
Aktincytoskelettbildning
Bildningen av aktincytoskelett kräver utarbetande av tvärbindningar mellan aktinfilament. Dessa länkar bildar proteiner, vars höjdpunkter är: de har domäner för förening till aktin; Många har homologa domäner till kalponin; och varje typ av protein uttrycks i en viss typ av cell.
I filopoder och stressfibrer tillverkas korsbindningar mellan aktinfilament av Fascin och Philamine. Dessa proteiner gör aktinfilamenten parallella eller har olika vinklar. Därför definierar aktinfilament formen på cellen.
Cellregionen med den högsta mängden aktinfilament ligger nära plasmamembranet. Denna region kallas cortex. Kortikalt cytoskelett är organiserat i olika former, beroende på celltyp och ansluter till plasmamembranet genom fixering av proteiner.
Några av de bäst beskrivna cytoskeletten är muskelceller, blodplättar, epitelceller och erytrocyter. Till exempel, i muskelceller, sammanfogar dystrofinfixativproteinet aktinfilament till ett omfattande glykoprotikkomplex av membranet. Detta komplex binder till extracellulära matrisproteiner.
Aktin-miosininteraktionsmodell
Rayment -ledda forskare föreslog en fyra -stegsmodell för att förklara interaktionen mellan aktin och myosin. Det första steget inträffar med föreningen av ATP till myosinhuvuden. Denna fackförening genererar en konformationell förändring i proteinet och frigör det från aktin i det lilla filamentet.
Sedan hydrolyseras ATP till ADP och frigör ett oorganiskt fosfat. Myosinmolekylen är förankrad till en ny aktinsubenhet, vilket genererar ett högt energitillstånd.
Frigörandet av oorganiskt fosfat medför en förändring i myosin, återgår till den första konformationen och rörelsen av de små filamenten, med avseende på de tjocka filamenten, med avseende på de tjocka filamenten. Denna rörelse orsakar rörelsen av sarkomens två ändar och närmar sig dem.
Det sista steget innebär att ADP släpps. Vid denna tidpunkt är huvudet på myosin gratis och kan gå med i en ny ATP -molekyl.
Det kan tjäna dig: Biologi: Historia, vilka studier, grenar, baserCellrörelse drivs av aktinpolymerisation
Rektor rörlighet är en typ av cellmotilitet. Stegen för denna typ av rörlighet är: projektion av den ledande vidhäftningsaxeln till underlaget; vidhäftning till substrat; bakre tillbakadragning; och des-vidhäftning.
Projektionen av den ledande axeln kräver deltagande av proteiner, som deltar i polymerisation och depolimerisering av aktinfilament. Den ledande axeln ligger i cellbarken, kallad lamellipodio. Projektionsstegen för axeln är:
- Receptoraktivering med extracellulär signal.
- Bildning av aktiv GTPAS och 4,5-biskoposfatfosfoinositol (PIP2).
- WASP/SCAR och ARP2/3 -proteinaktivering, som binder till aktinmonomerer för att bilda förgreningar i aktinfilament.
- Snabb tillväxt av aktinfilament, i slutet dekorerad med myosin, förgrening. Membranstjutningen produceras framåt.
- Kulmination av töjning producerad av täckproteiner.
- ATP -hydrolys fäst vid aktin i de äldsta filamenten.
- Depolimerisering av aktin-AD av filamenten som främjas av ADF/Cofilina.
- ADP-utbyte av ATP katalyserad av profylain, vilket genererar aktin G-ATP redo att starta elongära konsekvenser.
Aktinrelaterade sjukdomar
Muskeldystrofi
Muskeldystrofi är en degenerativ sjukdom i skelettmuskeln. Det ärftligt recessivt och är kopplat till X -kromosomen. Påverkar huvudsakligen män med hög frekvens i befolkningen (en av 3.500 män). Mödrarna till dessa män är asymptomatiska heterozygota och kan sakna familjehistoria.
Det finns två former av muskeldystrofi, Duchenne och Becker, och båda orsakas av defekter i dystrofingenen. Dessa defekter består av borttagningar som eliminerar axoner.
Dystrofin är ett protein (427 kDa) som bildar korsbindningar mellan aktinfilament. Det har en behärskning av föreningen att aktin i N-terminalen och en behärskning av membranföreningen i C-terminalen. Mellan båda domänerna finns en tredje tubulär domän som bildas av 24 tandemrepetitioner.
I muskelkortikalt retikulum deltar dystrofin i föreningen av aktinfilament till plasmamembranet genom ett glykoprotikkomplex. Detta komplex binder också till extracellulära matrisproteiner.
Hos patienter som saknar funktionell dystrofin, med Duchennes muskeldystrofi, stöder inte kortikalt cytoskelett plasmamembranet. Följaktligen skadas plasmamembranet av spänningen av upprepade muskelkontraktioner.
Referenser
- Devlin, t.M. 2000. Biokemi. Redaktionell återvändelse, Barcelona.
- Gunst, s.J., och Zhang, W. 2008. Actin Cytoskeletal Dynamic in Smooth Muskel: Ett nytt paradigm för reglering av muskelkontraktion. Am J Physiol Cell Physiol, 295: C576-C587.
- Lodish, h., Berk, A., Zipurski, s.L., Matsudaria, s., Baltimore, D., Darnell, J. 2003. Cellulär och molekylärbiologi. Redaktör Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Mexiko, Sāo Paulo.
- Nelson, D. L., Cox, m. M. 2008. Lehninger-principer för biokemi. W.H. Freeman, New York.
- Pfaendtner, j., Från korset och. M., VOTH, G. 2010. Actin Filament Remodeling med aktin depolymerisationsfaktor/cofilin. PNAS, 107: 7299-7304.
- Pollard, t.D., Borisy, g.G. 2003. Cellulär rörlighet som drivs av montering och demontering av aktinfillament. Cell, 112: 453-465.
- « Apolipoproteins Vad är, funktioner, typer
- Primär alkoholstruktur, egenskaper, nomenklatur, exempel »

