Primär alkoholstruktur, egenskaper, nomenklatur, exempel

- 2830
- 791
- Johan Olsson
En primär alkohol Det är en där hydroxylgruppen är kopplad till ett primärt kol; Detta är, ett kovalent fästa kol till ett annat kol och hydrogener. Hans allmänna formel är ROH, särskilt RCH2Åh, eftersom det bara finns en hyresgrupp r.
RCH Formel R Group R2Åh det kan vara vem som helst: en kedja, en ring eller heteroatomer. När det gäller en kedja, kort eller lång, är det före de mest representativa primära alkoholerna; Bland dem är metanol och etanol, två av de mest syntetiserade på industriella nivåer.
 Ölburk: Ett exempel på en vattenhaltig lösning av etylalkohol, en primär alkohol, i en organisk matris. Källa: Engin Akyurt via Pexels.
Ölburk: Ett exempel på en vattenhaltig lösning av etylalkohol, en primär alkohol, i en organisk matris. Källa: Engin Akyurt via Pexels. Fysiskt är de som andra alkoholer, och deras kokande eller fusionspunkter beror på graden av deras konsekvenser; Men kemiskt är de de mest reaktiva. Dessutom är dess surhet överlägsen den för sekundära och tertiära alkoholer.
Primära alkoholer upplever oxidationsreaktioner och blir ett brett antal organiska föreningar: estrar och etrar, aldehyder och karboxylsyror. De kan också drabbas av uttorkningsreaktioner och bli alkener eller olefiner.
[TOC]
Struktur av en primär alkohol
Primära alkoholer härrörande från linjära alkaner är de mest representativa. I verkligheten kan emellertid någon struktur, oavsett om det är linjär eller grenad, klassificeras inom denna typ av alkoholer så länge OH -gruppen är kopplad till en CH2.
Så strukturellt har alla gemensamt närvaron av gruppen -ch2Åh, kallad metylol. En egenskap och en följd av detta faktum är att OH -gruppen är mindre förhindrad; det vill säga det kan interagera med miljön utan andra atomer som hindrar rumsligt.
En mindre förhindrad OH betyder också att kolatomen som bär det, välj2, kan drabbas av ersättningsreaktioner genom en SN -mekanism2 (Bimolekylär, utan bildning av en Carbocation).
Å andra sidan, en OH med större frihet att interagera med miljön, översätter som starkare intermolekylära interaktioner (med vätebroar), vilket i sin tur ökar fusions- eller kokpunkterna.
Det kan tjäna dig: nickelhydroxid (iii): struktur, egenskaper, användningar, riskerDet händer också med dess löslighet i polära lösningsmedel, så länge grupp R inte är särskilt hydrofob.
Egenskaper
Aciditet
Primära alkoholer är från alla de mest sura. För att en alkohol ska bete sig som en Brnsted -syra måste en jon h donera+ till mitten, att säga vatten, att bli en alkoxidanjon:
ROH + H2GULD- + H3ANTINGEN+
Den negativa belastningen på det röda-, specifikt av RCH2ANTINGEN-, Känn dig mindre repulsion från elektronerna i de två C-H-bindningarna än av elektronerna i C-R-bindningen.
Hyregruppen utövar sedan den största avvisningen, destabiliserande RCH2ANTINGEN-; Men inte så mycket jämfört med det faktum att om det finns två eller tre R -grupper, som är fallet med sekundära respektive tertiära alkoholer.
Ett annat sätt att förklara den största surheten hos en primär alkohol är genom skillnaden i elektronegativitet, vilket skapar dipolmomentet: h2CΔ+-ANTINGENΔ-H. Syre lockar elektronisk densitet båda av CH2 från H; Den positiva partiella belastningen av kol avvisar lite väte.
Group R överför lite av sin elektroniska densitet till Cho2, vilket hjälper till att minska dess positiva partiella belastning och med den avvisande för vätebelastningen. Ju fler RA -grupper, desto lägre avvisande, och därför trenden med H som ska släppas som h+.
Pka
Primära alkoholer betraktas som svagaste syror än vatten, med undantag av metylalkohol, vilket är något starkare. PKA för metylalkohol är 15,2; Och PKA för etylalkohol är 16,0. Under tiden är vattnet PKA 15,7.
Vatten som betraktas som en svag syra, som alkoholer, kan dock gå med h+ För att förvandlas till hydriumjonen, h3ANTINGEN+; det vill säga det uppför sig som en bas.
På samma sätt kan primära alkoholer fånga väte; särskilt i några av de reaktioner som är dess egna, till exempel i deras omvandling till alkener eller olefiner.
Kemiska reaktioner
Hyra Halogenuros -bildning
Alkoholer reagerar med vätehalogenider för att producera alkylhalogenider. Reaktiviteten hos alkoholerna framför väte -halogeniderna, sjunker i följande ordning:
Kan tjäna dig: kolTertiär alkohol> Sekundär alkohol> Primär alkohol
ROH +HX => RX +H2ANTINGEN
RX är en primär alkylhalogenid (välj3Cl, ch3Ch2Br, etc.).
Ett annat sätt att framställa alkylhalogenuros är genom reaktionen av tioniloklorid, ett syntetiskt reagens, med en primär alkohol som blir en alkylklorid. Tionilo klorid (SOCL2) kräver att reagera närvaron av pyridin.
Ch3(Ch2)3Ch2OH +SOCL2 => Ch3(Ch2)3Ch2Cl +så2 + Hcl
Denna reaktion motsvarar halogeneringen av 1-Penol för att bli 1-kloropentano i närvaro av pyridin.
Oxidation av primära alkoholer
Alkoholer kan oxideras till aldehyder och karboxylsyror, beroende på reagens. Pyridiniumklorokromat (PCC) oxiderar primär alkohol till aldehyd, med användning av diklormetanen som lösningsmedel (CH2Kli2):
Ch3(Ch2)5Ch2Oh => cho3(Ch2)5Koh
Detta är oxidationen av 1-heptanol i 1-heptanal.
Under tiden kaliumpermanganat (KMNO4) Alkohol alkohol först och oxideras sedan till aldehyden till karboxylsyra. När kaliumpermanganat används för att oxidera alkoholer, bör brytningen av länken mellan kol 3 och 4 undvikas.
Ch3(Ch2)4Ch2Oh => cho3(Ch2)4Cooh
Detta är oxidationen av 1-hexanol till hexansyra.
Med denna metod är det svårt att få en aldehyd, eftersom den lätt oxiderar en karboxylsyra. En liknande situation observeras när kromsyra används för att oxidera alkoholer.
E Éteres formation
Primära alkoholer kan bli etrar när de värms upp i närvaro av en katalysator, vanligtvis svavelsyra:
2 RCH2Oh => rch2Ägg2R +h2ANTINGEN
Organisk esaresbildning
Kondensationen av en alkohol och en karboxylsyra, fiskaresterifiering, katalyserad av en syra, producerar en ester och vatten:
Kan tjäna dig: Carbococation: Bildning, egenskaper, typer, stabilitetR'OH +RCOOH RCOOR ' +H2ANTINGEN
En välkänd reaktion är etanol med ättiksyra för att ge etylacetat:
Ch3Ch2Oh +ch3COOH CH3Coohch2Ch3 + H2ANTINGEN
Primär alkohol är den mest mottagliga för Fischer -sterifieringsreaktioner.
Uttorkning
Vid höga temperaturer och i ett surt medium, vanligtvis svavelsyra, dehydrater alkoholer för att orsaka alkener med förlusten av en vattenmolekyl.
Ch3Ch2Oh => h2C = ch2 + H2ANTINGEN
Detta är dehydratiseringsreaktionen av etanol till eten. En mer lämplig allmän formel för denna typ av reaktion, speciellt för en primär alkohol, skulle vara:
Rch2Oh => r = cho2 (Vad är också lika med RC = CH2)
Nomenklatur
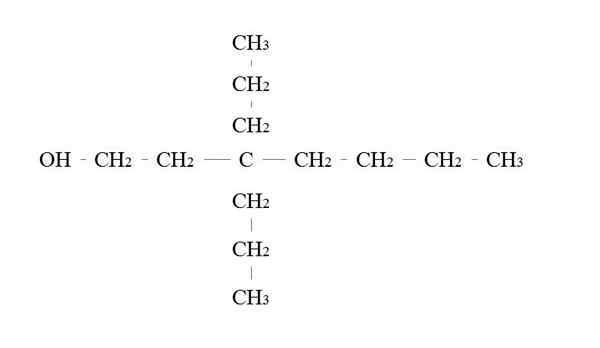 Primär alkoholexempel. Källa: Gabriel Bolívar.
Primär alkoholexempel. Källa: Gabriel Bolívar. Reglerna för att namnge en primär alkohol är desamma som för de andra alkoholerna; Med undantag är det ibland inte nödvändigt att räkna upp OH.
I den övre bilden finns en viktig sju -kolkedja. Kol kopplat till OH tilldelas antalet 1, och sedan börjar det räkna från vänster till höger. Dess IUPAC-namn är därför: 3.3-dietilheptanol.
Observera att detta är ett exempel på en mycket grenad primär alkohol.
Exempel
Slutligen nämns vissa primära alkoholer enligt deras traditionella och systematiska nomenklatur:
-Metyl, ch3Åh
-Etyl, ch3Ch2Åh
-N-propyl, ch3Ch2Ch2Åh
-N-hexyl, ch3Ch2Ch2Ch2Ch2Ch2Åh
Dessa härstammar från linjära alkaner. Andra exempel är:
-2-fenyletanol, c6H5Ch2Ch2Åh (c6H5 = bensenring)
-2-propen-1-OC (allilisk alkohol), cho2= Chch2Åh
-1,2-taodiol, ch2Ohch2Åh
-2-kloroetanol (etyleklorhydrin), Clch2Ch2Åh
-2-buten-1-ol (krotilisk alkohol), ch3Ch = chch2Åh
Referenser
- Morrison, r.T. Och Boyd, r. N. (1987). Organisk kemi. (5ta Utgåva). Addison-Wesley Iberoamericana
- Carey, f. TILL. (2008). Organisk kemi. (6ta Utgåva). McGraw-Hill, Intermerica, redaktör S.TILL.
- Mel Science. (2019). Hur oxidationen av primära alkoholer äger rum. Återhämtat sig från: melscience.com
- Royal Society of Chemistry. (2019). Definition: Primära alkoholer. Återhämtat sig från: rsc.org
- Chriss e. McDonald. (2000). Oxidationen av primära alkoholer till estrar: Tre relaterade undersökningsexperiment. J. Kem. Utbildare., 2000, 77 (6), s 750. Doi: 10.1021/ed077p750

