Isoamilico alkoholhaltig struktur, egenskaper, användningar och risker
- 5074
- 1636
- Johan Johansson
han Isoamylalkohol Det är en organisk förening vars formel är (ch3)2Chch2Ch2Åh. Kemiskt sett är en grenad primär alkohol och utgör en av pentanolisomererna, kallad amylalkoholer (C5H12ANTINGEN).
Liksom många alkoholer med låg molekylvikt är det en färglös vätska vid rumstemperatur. Detta tillåter och underlättar att det används som lösningsmedel för olika applikationer; Dessutom, när det inte utövar för många negativa effekter på ekosystemet efter kassering.
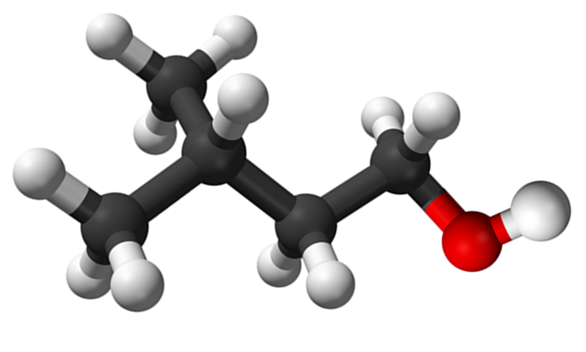
 Isoamilisk alkoholmolekyl. Källa: Claudio Pistilli de Wikipedia.
Isoamilisk alkoholmolekyl. Källa: Claudio Pistilli de Wikipedia. Även om det är ett mellanliggande material i syntesen av amiloacetat för utarbetande av banan dofter, är sin egen lukt obehaglig och liknar päron.
Förutom att tjäna som ett lösningsmedel för flera biologiska ämnen, och som en mellanhand i syntesen av andra acetater, minskar det ytspänningen för vissa industriella formuleringar, vilket förhindrar att skum bildas. Därför används det i mikroemulgerade system.
Beträffande dess naturliga ursprung har isoamilisk alkohol hittats i horomonas av hornets, och i de svarta tryfflarna, en typ av svampar i Europeiska Sydost.
[TOC]
Isoamilico -struktur
I den övre bilden visades isoamylalkoholmolekylen representerad med en sfärer och staplar -modell. Till höger om samma motsvarar den rödaktiga sfären syreatomen i OH -gruppen, karakteristisk för alla alkoholer; När du är till vänster finns det kolsyrade skelett med en metylgrupp, Cho3, Brancing strukturen.
Ur molekylär synvinkel är denna förening dynamisk för att ha atomer med SP -hybridationer3, underlättar rotationen av deras länkar; Så länge det inte får Oh och Cho att förmörkelse3.
Det är också värt att nämna sin amfifiliska egenskap: den har ett apolärt eller hydrofobt slut, som består av kedjan (CH3)2Chch2Ch2-, och ett polärt eller hydrofilt huvud, OH -gruppen. Denna definition av två specifika områden med olika polariteter gör denna alkohol till en tenseaktiv; Och härifrån beror det på sin tillämpning om mikroemulsioner.
Kan tjäna dig: spakregelIntermolekylär interaktioner
Med tanke på närvaron av OH -gruppen presenterar den isoamiliska alkoholmolekylen ett permanent dipolmoment. Följaktligen dipol-dipolen.
Medan grenen av huvudkedjorna minskar effektiva interaktioner mellan molekyler, kompenserar vätebroar i denna alkohol för denna nedstigning, vilket gör att vätskan kokar vid 131 ° C, temperaturen högre än kokpunkten för vatten.
Det händer inte med dess fasta eller "is", som smälter till -117 ° C, vilket indikerar att dess intermolekylära interaktioner inte är tillräckligt starka för att hålla sina molekyler ordnade; Särskilt om Cho -gruppen3 som grenar huvudkedjan förhindrar bättre kontakt mellan molekyler.
Egenskaper
Fysiskt utseende
Färglös vätska.
Lukt och smak
Avfärdar en obehaglig lukt som liknar den hos päron och har en skarp smak.
Molmassa
88.148 g/mol.
Densitet
0,8104 g/ml vid 20 ° C. Det är därför mindre tätt än vatten.
Ång-densitet
Det är 3,04 gånger tätare än luft.
Ångtryck
2,37 mmHg vid 25 ° C.
Kokpunkt
131,1 ° C.
Smältpunkt
-117,2 ° C.
antändningspunkt
43 ° C (stängd kopp).
Självriktningstemperatur
340 ° C.
Löslighet
Det är relativt lösligt i vatten: 28g/l. Detta beror på att de mycket polära molekylerna i vattnet inte känner speciell affinitet för den kolsyrade isoamylalkoholkedjan. Om blandad skulle två faser observeras: en lägre, motsvarande vatten och en överlägsen, den av isoamylalkohol.
Däremot är det mycket mer lösligt i mindre polära lösningsmedel såsom: aceton, eter, kloroform, etanol eller glacial ättiksyra; och även i oljeeter.
Det kan tjäna dig: Laboratorietermometer: Egenskaper, vad är det för, användning, exempelGegga
3 738 CP vid 25 ° C.
Ytspänning
24,77 DINS/CM A 15 ° C.
Brytningsindex
1 4075 till 20 ° C.
Värmekapacitet
2 382 kJ/g · k.
Ansökningar
Råmaterial
Från isoamilisk alkohol andra estrar, tiofen och läkemedel såsom amilo -nitrit, validol (isavalerat mentil), bromisoval (bromobalerilurea), corvalol (en kallare tranquanar) och barbamil (amobarbital) (amobarbital),.
Doft
Förutom att de används för syntes av amiloacetat, som har en bananarom, erhålls andra fruktdoft som aprikos, apelsiner, plommon, körsbär och malt också från det. Därför är det en nödvändig alkohol i utarbetandet av många ätliga eller kosmetikprodukter.
Antispumant
Genom att minska ytspänningen främjar den användningen i mikroemulgerade system. Undvik praktiskt taget accelererad bubbelbildning, vilket minskar dem i storlek för att bryta dem.
Det hjälper också bättre att definiera gränssnittet mellan vattenhaltiga och organiska faser under extraktioner; Till exempel läggs den till fenol-kloroformens extraktorblandning i en 25: 1-andel. Denna teknik är avsedd för DNA -extraktion.
Extraktion
Isoamylalkohol gör också att du kan extrahera fetter eller oljor från olika prover, till exempel mjölk. Lös också paraffinvax, bläck, gummi, lack och cellulosaestrar.
Fortsätter med extraktioner, med det kan du få fosforsyra från järnfosfatiska minerallösningar.
Risker
Lagring och reaktivitet
Som alla vätskor som avger luktar kan det utgöra en överhängande risk för eld om platsen där temperaturen är för lagrad, ännu mer om det redan finns en värmekälla.
Under dessa förhållanden fungerar det helt enkelt som ett bränsle, matar lågorna och till och med utnyttjar behållaren. Släpp ångor som kan påverka hälsan och orsaka kvävning och orsaka kvävning.
Kan tjäna dig: kvantitativ analys i kemi: mätningar, förberedelserAndra orsaker som isoamilisk alkohol sätts i brand är att blanda den eller få den att reagera med ämnen som: peroxider, brome.
Hälsa
Vid kontakt med huden kan du irritera och torka ut den. Symtomen är emellertid mer allvarliga om det inhaleras för länge (hosta, näsa brännskador, hals och lungor), eller om det intas (huvudvärk, illamående, diarré, kräkningar, yrsel och kunskapsförlust)).
Och slutligen, när det spill i ögonen irriterar dem och till och med kan skada dem irreversibelt. Lyckligtvis låter dess lukt av "alkoholhaltiga päron" dig upptäcka den vid flykt eller spill; Utöver detta är det en förening som måste manipuleras med respekt.
Referenser
- Morrison, r. T. och Boyd, R, N. (1987). Organisk kemi. Femte upplagan. Redaktör Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. Aminer. (10: e upplagan.). Wiley Plus.
- Wikipedia. (2019). Isoamylalkohol. Hämtad från: i.Wikipedia.org
- Nationellt centrum för bioteknikinformation. (2019). Isoamylalkohol. Pubchemdatabas. CID = 31260. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Zhang Yu & Muhammed Mamoun. (17 september 2008). Extraktion av fosforsyra från nitratlösningar med isoamylalkohol. Lösningsutveckling och jonbytesvolym 6, 1988 - nummer 6. doi.org/10.1080/07366298808917973
- New Jersey Department of Health. (2008). Isoamylalkohol. [Pdf]. Återhämtat sig från: nj.Gov
- Kat kem. (2019). Isoamylalkohol. Återhämtat sig från: Kat-chem.Hu
- Chemoxy International Ltd. (s.F.). Isoamylalkohol. Återhämtat sig från: kemoxy.com

