Trietilaminstruktur, egenskaper, användningar och risker

- 3906
- 568
- Prof. Erik Johansson
De trietilamin Det är en organisk förening, mer exakt en alifatisk amin, vars kemiska formel är n (ch2Ch3)3 eller nät3. Liksom andra flytande aminer presenterar den en lukt som liknar den hos ammoniak blandat med fisk; Hans ångor gör tråkiga och farliga manipulera detta ämne utan lämplig extraktor eller kläder.
Förutom dess respektive formler förkortas det vanligtvis till denna förening som ASD; Detta kan emellertid orsaka förvirring med andra aminer, såsom trietanolamin, N (ETHOH)3, eller tetraetilamonium, en kvartär amina, nät4+.
 Trietylaminskelett. Källa: Blandningar [CC BY-SA 3.0 (http: // Creativecommons.Org/licenser/BY-SA/3.0/]]
Trietylaminskelett. Källa: Blandningar [CC BY-SA 3.0 (http: // Creativecommons.Org/licenser/BY-SA/3.0/]] Från dess skelett (överlägsen bild) kan man säga att trietylamin är ganska lik ammoniak; Medan den andra har tre hydrogener, NH3, Den första har tre etylgrupper, n (ch2Ch3)3. Syntesen börjar från behandlingen av flytande ammoniak med etanol, som förekommer en alkylering.
Nätet3 Du kan bilda ett hygroskopiskt salt med HCl: trietilaminhydroklorid, nät3· HCL. Utöver detta deltar han som en homogen katalysator i syntesen av estrar och amidas, så det är ett nödvändigt lösningsmedel i organiska laboratorier.
Tillsammans med andra reagens tillåter det oxidation av primära och sekundära alkoholer till aldehyder respektive ketoner. Som ammoniak är en bas, och därför kan den bilda organiska salter genom neutraliseringsreaktioner.
[TOC]
Trietylamin
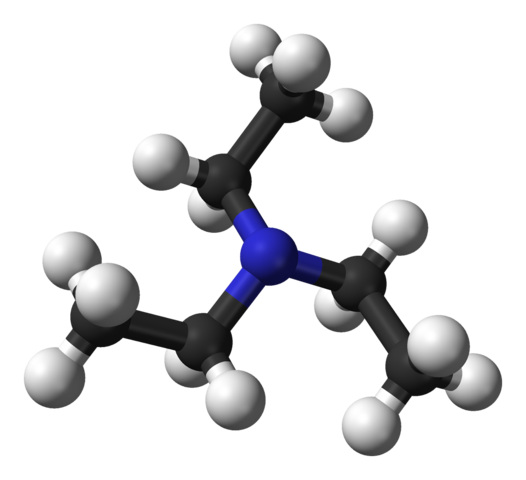 Trietylamin. Källa: Benjah-Bmm27 [Public Domain].
Trietylamin. Källa: Benjah-Bmm27 [Public Domain]. Den övre bilden visar strukturen för trietylamin med en modell av sfärer och staplar. I mitten av molekylen är kväveatomen belägen, representerad av en blåaktig sfär; Och kopplade till honom, de tre etylgrupperna, som små grenar av svarta och svarta sfärer.
Även om de inte är med blotta ögat, finns det på kväveatomen ett par inte delade elektroner. Dessa två elektroner och de tre grupperna -ch2Ch3 De upplever elektroniska avstötningar; Men å andra sidan bidrar de till att definiera molekylens dipolmoment.
Kan tjäna dig: cykloalcanos: egenskaper, reaktioner, användningar, exempelEmellertid är ett sådant dipolmoment lägre än till exempel dietylamin, NHET2; Och det saknar också någon möjlighet att bilda vätebroar.
Detta beror på att i trietylamin finns det ingen N-H-bindning, och följaktligen observeras mindre fusions- och kokpunkter jämfört med andra aminer som interagerar på ett sådant sätt.
Även om det finns ett litet dipolmoment, kan dispersionskrafter mellan etylgrupper av nätmolekyler inte uteslutas3 grannar. Att lägga till denna effekt är det motiverat varför den trietylamin är flyktig, den kokar runt 89 ° C, tack vare dess relativt stora molekylmassa.
Egenskaper
Fysiskt utseende
Färglös vätska med obehaglig lukt av ammoniak och fisk.
Molmassa
101,193 g/mol.
Kokpunkt
89ºC.
Smältpunkt
-115ºC. Observera hur svag de intermolekylära krafterna som förenar trietylaminmolekylerna i deras fasta.
Densitet
0,7255 g/ml.
Löslighet
Det är relativt lösligt i vatten, 5,5 g/100 g vid 20 ° C. Under 18,7 ºC, enligt Pubchem, är det till och med blandbart med detta.
Förutom att "komma överens" med vatten är det också lösligt i aceton, bensen, etanol, eter och paraffin.
Ång-densitet
3.49 i förhållande till luft.
Ångtryck
57,07 mmHg vid 25 ° C.
Henry Constant
66 μmol/pa · kg.
antändningspunkt
-15ºC.
Självriktningstemperatur
312ºC.
Värmekapacitet
216,43 kJ/mol.
Förbränningsvärme
10.248 kalk/g.
Förångningsvärme
34,84 kJ/mol.
Ytspänning
20,22 N/m A 25ºC.
Brytningsindex
1 400 till 20 ° C.
Gegga
0,347 MPa · s vid 25 ° C.
Basicitetskonstant
Trietilamin har en PKB lika med 3,25.
Basicitet
Basiciteten för denna amin kan uttryckas genom följande kemiska ekvation:
Kan tjäna dig: syntetiska polymererNetto3 + Ha nhet3+ + TILL-
Var är det en svag syraart. NHET -paret3+TILL- Det bildar vad som blir ett tertiärt ammoniumsalt.
NHET -konjugatsyra3+ Det är mer stabilt än ammonium, NH4+, Eftersom de tre etylgrupperna donerar en del av sin elektroniska densitet för att minska den positiva belastningen på kväveatomen; Därför är trietylamin mer grundläggande än ammoniak (men mindre grundläggande än åh-).
Ansökningar
 Reaktioner katalyserade av trietylamin. Källa: Tachymètre [Public Domain].
Reaktioner katalyserade av trietylamin. Källa: Tachymètre [Public Domain]. Basicitet, i detta fall används nukleofiliciteten hos trietylamin för att katalysera syntesen av ester och amider från ett vanligt substrat: en acylklorid, RCOCL (Superior Image).
Här attackerar kvävelektronerna fria par karbonylgruppen och bildar en mellanhand; som i följd attackeras av en alkohol eller en amin för att bilda en ester respektive amida.
I den första raden av bilden visualiseras mekanismen som följer reaktionen för att producera estern, medan den andra raden motsvarar Amida. Observera att i båda reaktionerna inträffar trietylaminhydroklorid, nät3· HCl, från vilken katalysatorn återvinns för att starta en annan cykel.
Polymerer
Nukleofiliciteten hos trietylamin används också för att lägga till vissa polymerer, läka dem och ge dem större massor. Till exempel är det en del av syntesen av polykarbonerade hartser, polyuretanskum och epoxihartser.
Kromatografi
Dess avlägsna amfifilicitet och volatilitet gör att dess härledda salter kan användas som reagens i jonbytekromatografi. En annan implicit användning av trietylemin är att flera salter av tertiära aminer kan erhållas från det, såsom trietylaminbikarbonat, NHET3Hco3 (eller TeB).
Kan tjäna dig: kalorimetri: vilka studier och applikationerKommersiella produkter
Det har använts som ett tillsatsmedel i formuleringen av cigaretter och tobak, matkonserveringsmedel, golv, smakämnen, bekämpningsmedel, färgämnen, etc.
Risker
Ångorna av trietylamin är inte bara obehagliga utan farliga, eftersom de kan irritera näsan, halsen och lungorna för att orsaka lungödem eller bronkit. På samma sätt, eftersom de är tätare och tunga än luften, förblir de på marknivå och flyttar till möjliga värmekällor för att därefter explodera.
Behållarna med denna vätska måste vara så långt ifrån eld eftersom de representerar en överhängande fara för explosion.
Dessutom kontakt med arter eller reagens såsom: alkaliska metaller, triklorättiksyra, nitrater, salpetersyra (som det skulle bilda nitrosoaminer, cancerframkallande föreningar), starka syror, peroxider och permaneraner.
Du bör inte röra vid aluminium, koppar, zink eller dess legeringar, eftersom det har förmågan att korrodera dem.
När det gäller fysisk kontakt kan det orsaka allergi och hudutslag om exponeringen är akut. Förutom lungorna kan det påverka levern och njurarna. Och när det gäller okulär kontakt orsakar det irritation, vilket till och med kan skada ögonen om de inte behandlas eller rengörs i tid.
Referenser
- Morrison, r. T. och Boyd, R, N. (1987). Organisk kemi. Femte upplagan. Redaktör Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. Aminer. (10: e upplagan.). Wiley Plus.
- Wikipedia. (2019). Tretylamin. Hämtad från: i.Wikipedia.org
- Merck. (2019). Tretylamin. Återhämtat sig från: Sigmaaldrich.com
- Nationellt centrum för bioteknikinformation. (2019). Tretylamin. Pubchemdatabas. CID = 8471. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Toxicology Data Network. (s.F.). Tretylamin. Återhämtat sig från: toxnet.Nlm.Nih.Gov
- New Jersey Department of Health. (2010). Tretylamin. Återhämtat sig från: nj.Gov
- « 10 nyfikenheter om medeltiden som kommer att överraska dig
- Isoamilico alkoholhaltig struktur, egenskaper, användningar och risker »

