Alfa Amilasa -egenskaper, struktur, funktioner
- 4350
- 1090
- PhD. Emil Svensson
De Alfa amilasa (a-amylas) är ett amilolitiskt enzym från endo amilasas-gruppen som är ansvarig för hydrolysen av a-1,4-bindningarna mellan glukosresterna som utgör olika typer av kolhydrater i naturen.
Systematiskt känd som systematiskt känd som a-1,4-glucan. Hos människor, till exempel, är amylaserna som finns i saliv och de som utsöndras av bukspottkörteln av a-amylasstyp.
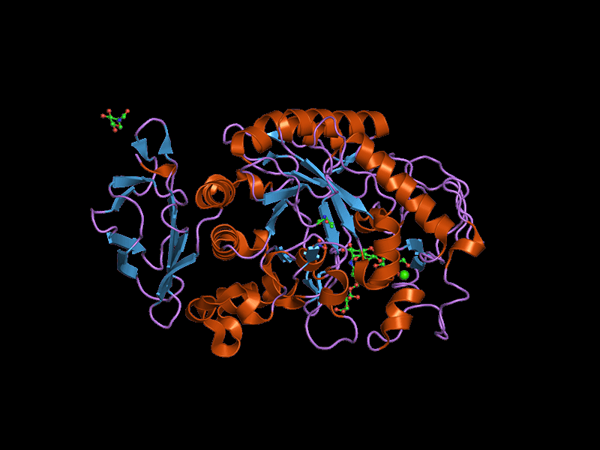
 C-terminal domänstruktur av Alfa Amilasa-djuret (källa: Jawahar Swaminathan och MSD-personal vid European Bioinformatics Institute [Public Domain] via Wikimedia Commons) via Wikimedia Commons) vid Europeiska bioinformatikinstitutet [Public Domain] via Wikimedia Commons) via Wikimedia Commons) vid
C-terminal domänstruktur av Alfa Amilasa-djuret (källa: Jawahar Swaminathan och MSD-personal vid European Bioinformatics Institute [Public Domain] via Wikimedia Commons) via Wikimedia Commons) vid Europeiska bioinformatikinstitutet [Public Domain] via Wikimedia Commons) via Wikimedia Commons) vid Kuhn var 1925 den första som myntade termen "a-amylas" baserat på det faktum att produkterna från hydrolys som katalyserar dessa enzymer har konfiguration a. Senare, 1968, fastställdes att dessa företrädesvis verkar på linjära och icke -förgrenade strukturella konfigurationssubstrat.
Liksom andra amilolitiska enzymer är a-amylas ansvarigt för hydrolysen av stärkelsen och andra relaterade molekyler såsom glykogen, vilket producerar mindre polymerer som består av upprepade enheter av glukos.
Förutom de fysiologiska funktioner som detta enzym har hos djur, växter och mikroorganismer som uttrycker det, representerar a-amylas, tillsammans med de andra klasserna av befintliga amylaser, 25% av de enzymer som används för industriella och bioteknologiska ändamål nuvarande marknadsmarknadsmarknad.
Många arter av svampar och bakterier är den viktigaste källan för att få a-amylaser som används oftare i industrin och vetenskapligt experiment. Detta beror främst på dess mångsidighet, dess enkla att få, dess enkla hantering och de låga kostnaderna relaterade till dess produktion.
[TOC]
Egenskaper
De a-amylaser som finns i naturen kan ha optimala pH-intervall med mycket olika pH för dess drift; Till exempel är optimalt för a-amylasdjur och växt mellan 5.5 och 8.0 pH -enheter, men vissa bakterier och svampar har fler alkaliska enzymer och mer acidicas.
Kan tjäna dig: fylogeniDe enzymer som finns i saliv- och däggdjurs bukspottkörtel fungerar bättre vid pH nära 7 (neutrala).
Både djur, saliv- och bukspottkörtelenzymer produceras i organismer av oberoende mekanismer som involverar specifika celler och körtlar och som förmodligen inte är relaterade till de enzymer som finns i cirkulationstorrenden och andra kroppshålrum.
Både pH och den optimala temperaturen för funktionen av dessa enzymer beror kraftigt på fysiologin för den organisme som beaktas, eftersom det finns extremofila mikroorganismer som växer under mycket speciella förhållanden med avseende på dessa och många andra parametrar.
Slutligen, när det gäller regleringen av dess aktivitet, är en karakteristik som delas mellan enzymerna i gruppen av a-amylaser att dessa, liksom andra amylaser, kan hämmas av tungmetalljoner såsom kvicksilver, koppar, silver och bly.
Strukturera
A-amylas är ett multidominiumenzym som hos djur och växter har en ungefärlig molekylvikt på 50 kDa och olika författare är överens om att enzymerna som tillhör denna familj av glycohydroles är enzymer med mer än tio strukturella domäner.
Den centrala domänen eller den katalytiska domänen är mycket bevarad och är känd som domän A, som består av en symmetrisk vikning av 8 p-pläterade ark arrangerade i form av en "fat" som är omgiven av 8 alfa-hallar, så du kan också hitta också hitta i litteratur hur (ß/α) 8 eller "TIM" -tum.
Det är viktigt att notera att i den C-terminala änden av p-ark i domän A är det bevarade aminosyravfallet som är involverat i katalys och i korsningen av substratet och att denna domän är belägen i det N-terminala regionen av proteinet.
Det kan tjäna dig: fauna och flora i det peruanska havetEn annan av de mest studerade domänerna för dessa enzymer är den så kallade Ding B, som sticker ut mellan den p-skalade lamina och alfa-nummer 3-propellen för domänen a. Detta spelar en grundläggande roll i föreningen av substrat och divalent kalcium.
Ytterligare domäner har beskrivits för a-amylassenzymer, såsom domäner C, D, F, G, H och I, som är belägna framför eller baksidan av domänen A och vars funktioner inte är kända exakt och beror på den organisme som det studeras.
a-amylaser av mikroorganismer
Molekylvikten för a-amylaser beror, liksom andra biokemiska och strukturella egenskaper, på den organismen som studeras. Således har a-amylaserna i många svampar och bakterier vikter så låga som 10 kDa och så höga som 210 kDa.
Den höga molekylvikten för några av dessa mikrobiella enzymer är ofta relaterad till närvaron av glykosilering, även om glykosylering av protein i bakterier är ganska sällsynt.
Funktioner
Hos djur är a-amylaser ansvariga för de första stegen i metabolismen av stärkelse och glykogen, eftersom de är ansvariga för deras hydrolys till mindre fragment. Organen i gastrointestinalt system som ansvarar för deras produktion hos däggdjur är bukspottkörteln och salivkörtlarna.
Utöver dess uppenbara metaboliska funktion betraktas produktionen av a-amylaser som produceras av salivkörtlarna hos många däggdjur, aktiverade av noradrenalin.
Den har också sekundära funktioner i oral hälsa, eftersom dess aktivitet fungerar i eliminering av orala bakterier och i förebyggandet av dess vidhäftning till orala ytor.
Det kan tjäna dig: Sympatric Speciation: Concept, Egenskaper och exempelHuvudfunktion i växter
I växter spelar a-amylaser en primär roll i spiring av frön, eftersom de är enzymerna som hydrolyserar den stärkelse som finns i endospermen som närar embryot inuti, processen som väsentligen kontrolleras av gibberelin, ett fytormon.
Industrianvändning
Enzymer som tillhör familjen av a-amylaser har flera tillämpningar i många olika sammanhang: industriella, vetenskapliga och bioteknologiska, etc.
I stora stärkelsebearbetningsindustrier används a-amylaser populärt för glukos- och fruktosproduktion, liksom för produktion av bröd med förbättrade strukturer och med större lojal kapacitet.
Inom det biotekniska området finns det mycket intresse för förbättringen av de enzymer som kommersiellt används för att förbättra deras stabilitet och prestanda under olika förhållanden.
Referenser
- Aiyer, s. V. (2005). Amylaser och deras tillämpningar. Afrikansk tidskrift för bioteknik, 4(13), 1525-1529.
- Bernfeld, s. (1960). Amylaser, A och B. I Enzymer av kolhydratmetabolism (Vol. Jag, PP. 149-158).
- Granger, D. TILL., Kivighan, K. T., M., Gordis, E. B., & Stud, L. R. (2007). Saliv A-ochlas i biobeteendeforskning. Senaste utvecklingen och ansökningar. Ann. N.OCH. Akad. Sci., 1098, 122-144.
- Monteiro, s., & Oliveira, s. (2010). Applicering av mikrobiell A-Andlas i branschen- en översyn. Brasiliansk tidskrift för mikrobiologi, 41, 850-861.
- Reddy, n. S., Nimmagadda, a., & Rao, K. R. S. S. (2003). En översikt över den mikrobiella a-kärleksfamiljen. Afrikansk tidskrift för bioteknik, 2(12), 645-648.
- Salt, w., & Shenker, s. (1976). Amylase- dess kliniska betydelse: en översyn av litteraturen. Medicin, 55(4), 269-289.
- Svensson, f., & MacGregor, och. TILL. (2001). Förhållande mellan sekvens och struktur och specificitet i a-amylasfamiljen av enzymer. Biochimica et Biophysica Acta, 1546, 1-20.
- Thoma, J. TILL., Spradlin, J. OCH., & Dygert, s. (1925). Växt- och djuramylaser. Ann. Kem., 1, 115-189.
- « Reninstruktur, produktion, utsöndring, funktioner
- Urie Bronfenbrenner -biografi, ekologisk modell och bidrag »

