Alkener
- 1334
- 98
- Per Eriksson
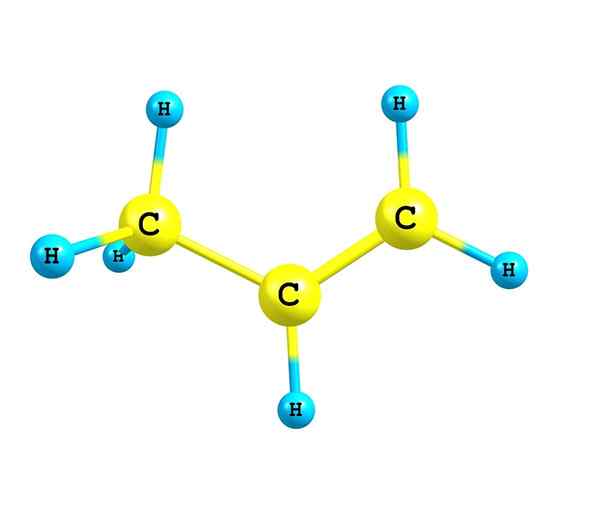
 Alkenes eller olefiner är omättade kolväten som har åtminstone en dubbel kol-kolbindning i sin struktur
Alkenes eller olefiner är omättade kolväten som har åtminstone en dubbel kol-kolbindning i sin struktur Vad är alkener?
De alkener eller olefiner De är omättade kolväten som har minst en dubbelbindning i sin struktur. De kallas olefiner på grund av etenens eller etenens förmåga att reagera med halogener för att producera olja eller olja. För närvarande har termen olefinas avbrutits och dessa föreningar kallas nu alkenes.
Alkenes fysiska egenskaper påverkas av deras molekylvikt, liksom deras kolsyrade skelett. Till exempel är alkener med 2 till 4 kol (Buteno etene) gaser. Med 5 till 18 kolatomer i den långa kedjan är flytande. Medan alkener med mer än 18 kolatomer är solida.
Närvaron av dubbelbindning ger stor reaktivitet och upplever därmed många kemiska reaktioner, såsom tillägg, eliminering, hydrering, hydrering och polymerisation, som gör att den kan generera många användningsområden och tillämpningar.
Alkener produceras industriellt genom termisk sprickbildning av hög molekylvikt (paraffinvax); Katalytisk dehydrogenering och klorering-dehydrokloklinering.
Alkenernas kemiska struktur
 Källa: Självgjord
Källa: Självgjord Alkenes kännetecknas av att ha en eller flera dubbellänkar i sin struktur. Detta representeras som C = C, med båda kolatomerna en SP -hybridisering2.
Därför är kedjeregionen där dubbelbindningen är eller omättning är platt. Det är också meritor att påpeka att de två kolhydrater kan kopplas till två andra substituenter (eller grupper).
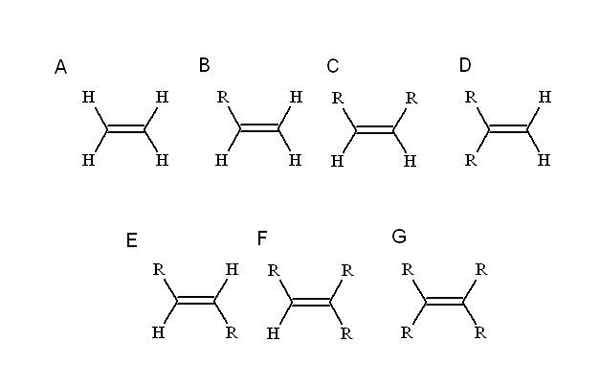
Vilka substituenter? Den som ersätter en av de enklaste alkenens hydrogener: eten (eller eteno). Börjar från honom (a, överlägsen bild) r, som är en alquilisk substituent, upptar platsen för en av de fyra hydrogener för att orsaka en mono-substituerad alken (b).
Hittills, oavsett vilket väte ersätts, ändras inte identiteten på B. Detta innebär att det saknar stereoisomerer, sammansatta med lika kemiska formler men med en annan rumslig disposition av dess atomer.
Kan tjäna dig: ekvivalenspunktStereoisomerer
När ett andra väte ersätts av en annan R, som i C, nu stereoisomererna C, D och E. Detta beror på att rumsliga orienteringar med avseende på både R kan variera och för att urskilja varandra används CIS-trans- eller E-Z-uppdrag.
I C, di-substitute alken, kan de två R vara kedjor av vilken längd som helst eller någon heteroátomo. Den ena är i frontposition i förhållande till den andra. Om de två R består av samma substituent, F, till exempel, är C stereoisomer-cis.
I D är båda R -grupperna ännu närmare, eftersom de är kopplade till samma kolatom. Detta är den geminala stereoisomeren, även om mer än en stereoisomer är faktiskt en terminal dubbelbindning, det vill säga att det är i slutet eller principen för en kedja (av den anledningen har den två hydrogener det andra kolet).
Och i E, den mest stabila av stereoisomerer (eller geometriska isomerer), separeras de två R -grupperna med ett större avstånd, som korsar diagonalen för dubbelbindningen. Varför är den mest stabila? Det beror på att eftersom den rumsliga separationen mellan dem är större, så det finns ingen systerspänning mellan de två.
Å andra sidan är f och g tri- respektive tetra-repeterade alkener. Återigen kan de inte generera någon stereoisomer.
Alkenes fysiska och kemiska egenskaper
Löslighet
De är oblandbara med vatten på grund av deras låga polaritet. Men de upplöses i organiska lösningsmedel.
Fusionspunkter vid ºC
Etano -169, propen -185, 1 -pentin -165, 1 -Hepteno -119, 3 -Oktin
-101.9, 3 -None -81.4 och 5 -Dechenum -66,3.
Kokpunkt i º C
Etano -104, propeno -47, trans2Buteno 0,9, Cis2-Buteno 3,7, 1-Penten 30, 1-Hepteno 115, 3-OK 122, 3-Noneno 147 och 5-decend.
Kan tjäna dig: laboratoriefilter): egenskaper, funktioner, typerKokpunkten ökar i direkt relation till antalet alkenkolor. Å andra sidan, ju mer grenade dess struktur, desto svagaste är dess intermolekylära interaktioner, vilket återspeglas i minskningen av kokande eller fusionspunkt.
Densitet
Etano 0,6128 mg/ml, propen 0,6142 mg/ml och 1-buten 0,6356 mg/ml, 1-pent 0,64 mg/ml och 1-hexen 0,673.
I alkener är den maximala densiteten 0,80 mg/ml. Det vill säga de är mindre täta än vatten.
Polaritet
Det beror på den kemiska strukturen, substitutionerna och närvaron av andra funktionella grupper. Alkenes har en doppare, alltså 2-buten Cis-isomeren.
Alkenes reaktivitet
Alkenes har stor kapacitet att reagera på grund av de dubbla länkar de har. Bland de involverade reaktionerna är: Tillägg, eliminering, ersättning, hydrering, hydrering och polymerisation.
Tilläggsreaktion
H2C = ch2 + Kli2 => Clch2-Cclh2 (etendiklorid)
Hydreringsreaktion
Det förekommer vid höga temperaturer och i närvaro av adekvata katalysatorer (PT, PD eller fint uppdelad)
Ch2= Ch2 + H2 => Ch3-Ch3 (Etano)
Hydreringsreaktion
Reaktion som är källan till alkoholproduktion från oljederivat:
H2C = ch2 + H2O => h3C-ch2Åh (etylalkohol)
Polymerisationsreaktioner
Etylen i närvaro av katalysatorer såsom aluminiumstudier och titan -tetrakloridpolymeriza i polyeten, som innehåller cirka 800 kolatomer. Denna typ av polymer kallas tilläggspolymeren.
Användning och tillämpningar av alkener
Polymerer
- Polyeten med låg densitet används vid tillverkning av påsar, växthusplast, förpackning, rätter, kärl, etc. Medan den höga densiteten är mer styv och mekaniskt resistent, använder du i tillverkning av lådor, möbler, skyddare som hjälmar och knän, leksaker och pallar.
- Polypropylen, propylenpolymer, används i utarbetandet av containrar, ark, laboratorieutrustning, leksaker, förpackningsfilmer, SOGAS -filament, klädsel och mattor.
- Polyvinylklorid (PVC) är en polymer av vinylklorid som används vid tillverkning av rör, plattor för golv, kanaler, dörrar och fönsterramar etc.
- Polybutadien, polymer av 1,3-butadien, är avsedd för tillverkning av lagerband, slangar och fordonsbälten samt för beläggningen av metallburkar.
- Etylen- och propylensampolymerer används vid tillverkning av slangar, kropp och delar av chassit för textilier etc.
Alkener
- De används för att få lösningsmedel som etylenglykol och dioxan. Etylenglykol används som en frostskyddsmedel i bilradiatorer.
- Etylen är ett hormon av växter som kontrollerar dess tillväxt, fröspiring och utveckling av frukt. Därför används det för att inducera mognad av bananer när de når sin destination.
- De används som råmaterial för tillverkning av många föreningar såsom alkylhalider, etenoxid och särskilt etanol. De har också användning inom bransch, personlig vård och medicin.
- De används för att erhålla och tillverka lacker, tvättmedel, aldehyder och bränslen. 1.3-Butadieno används som råmaterial i tillverkningen av syntetiska gummi.
Referenser
- Kemiuppdrag. Alkenes fysikaliska egenskaper. Taget från: kemi-tilldelning.com
- Wikipedia. (2018). Alken. Taget från: i.Wikipedia.org
- Kemi librettexts. Alkenes fysikaliska egenskaper. Taget från: Chem.Librettexts.org
- Whitten, Davis, Peck & Stanley. Kemi. (8: e upplagan.). Cengage Learning.
- Francis A. Sköldpaddsskal. Organisk kemi. (Sjätte upplagan., Sidan 194). MC Graw Hill.
- Houchton Mifflin Harcourt. (2016). Alkenes: Molekylära och strukturella formler. Taget från: CliffsNotes.com
- Chiper, Angie. (25 april 2017). Vad är en olefin inom kemi? Forskning. Taget från: forskning.com

