Amfoter som är, typer och exempel
- 4411
- 891
- PhD. Lennart Johansson
De Amfostrar De är föreningarna eller jonerna som har en egenhet att kunna bete sig som en syra eller som bas, enligt Bronsted och Lowry Theory. Hans namn kommer från det grekiska ordet Ampoteroi, vilket betyder "båda".
Många metaller bildar amphoterosoxider eller hydroxider, inklusive koppar, zink, tenn, bly, aluminium och beryllium. Amphoter -karakteristiken för dessa oxider beror på oxidationstillstånden för oxiden i fråga. I slutet av artikeln ingår exempel på dessa ämnen.

Metalloxider som kan reagera med syror och baser för att producera salter och vatten kallas amfoterosoxider. Bly- och zinkoxider är mycket bra exempel, bland andra föreningar.
[TOC]
Vad är amphoter?
Enligt Bronsted och Lowrys syra-basteori är syror de ämnen som donerar protoner, medan baserna är de som accepterar eller tar protonerna.
En molekyl som kallas amfotat kommer att ha reaktioner där det förvärvar protoner, eftersom det också kommer att ha förmågan att donera dem (även om det inte alltid är så, vilket kommer att ses i nästa avsnitt).
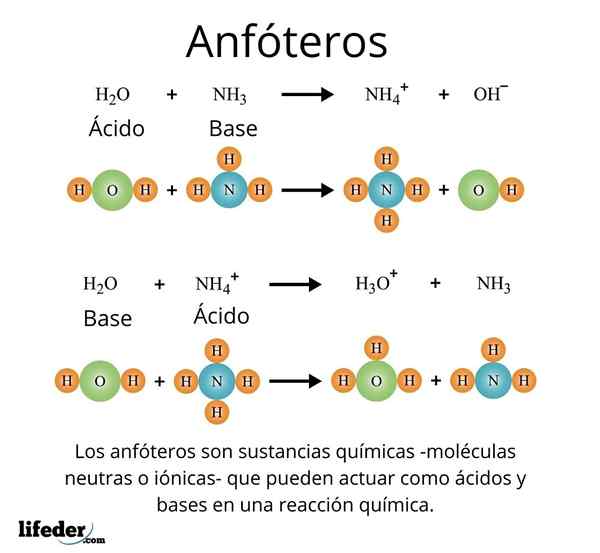
Ett viktigt och välkänt fall är det universella lösningsmedlet, vatten (H₂O). Detta ämne reagerar lätt med syror, till exempel i reaktion med saltsyra:
H2O + HCl → H3ANTINGEN+ + Kli-
Men i sin tur har han inte heller problem med att reagera med en bas, som i fallet med ammoniak:
H2O + nh3 → NH4 + Åh-
Med dessa exempel kan det observeras att vatten fungerar fullt ut som ett amfotatämne.
Typer av amphoters
Även om amfotenta ämnen kan vara molekyler eller joner, finns det molekyler som bäst visar amfotenta egenskaper och hjälper till att studera detta beteende bättre: amfrofrotiska ämnen. Dessa är molekyler som specifikt kan donera eller acceptera en proton för att fungera som syra eller bas.
Kan tjäna dig: Rodio: Historia, egenskaper, struktur, användningar, riskDet bör klargöras att alla amfotiska ämnen är amfotiska, men inte alla amfoter är amfiprtiska; Det finns amfotoros som inte har protoner, men de kan bete sig som syror eller baser på andra sätt (som Lewis's Theory).
Bland de amfipriska ämnena är vatten, aminosyror och bikarbonat- och sulfatjoner. I sin tur är amfrofotiska ämnen också underklassificerade enligt deras förmåga att donera eller ge protoner:
Protogena eller amfiprytinsyraresubblar
Är de som har en större tendens att ge en proton än att acceptera en. Bland dessa är svavelsyra (h2Sw4) och ättiksyra (Cho3COOH), bland andra.
Grundläggande protofila eller amfotiska ämnen
De är de för att acceptera en proton är vanligare än att ge den. Bland dessa ämnen kan du hitta ammoniak (NH3) och etylendiamid [c2H4(NH2)2].
Neutrala ämnen
De har samma lätthet eller förmåga att acceptera en proton som att ge upp den. Bland dessa är vatten (h2O) och mindre alkoholer (-roH), främst.
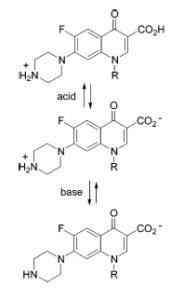 Ampotero karaktär av kinoloner
Ampotero karaktär av kinoloner Exempel på amfotenta ämnen
 Amphotero spänning
Amphotero spänning Nu har du redan beskrivit de amfotenta ämnena Det är nödvändigt att beteckna exemplen på reaktioner där dessa egenskaper presenteras.
Jonen av kolsyran presenterar ett grundläggande fall av ett amfiprtiskt ämne; Sedan representeras deras reaktioner när det fungerar som en syra:
Hco3- + Åh- → CO32- + H2ANTINGEN
Nästa reaktion inträffar när den fungerar som bas:
Hco3- + H3ANTINGEN+ → H2Co3
Det finns också många andra ämnen. Av dessa är följande exempel:
Amphoteros oxider
Zinkoxid, som redan nämnts, är en amphotero men inte en amfiprisk substans. Därefter demonstreras det varför.
Kan tjäna dig: Justus von LiebigBete sig som syra:
Zno + h2Sw4 → ZnSO4 + H2ANTINGEN
Bete sig som bas:
Zno + 2naoh + h2O → na2[Zn (OH)4]
Blyoxid (PBO), aluminium (Al2ANTINGEN3) och tenn (SNO) har också sina egna amfotenta egenskaper:
Uppträder som syror:
PBO + 2HCL → PBCL2 + H2ANTINGEN
Till2ANTINGEN3 + 6HCL → 2Alcl3 + 3 timmar2ANTINGEN
SNO + HCL ↔ SNCL + H2ANTINGEN
Och som baser:
PBO + 2NAOH + H2O → na2[PB (OH)4]
Till2ANTINGEN3 + 2NAOH + 3H2O → 2na [Al (OH)4]
SNO + 4NAOH + H2Eller ↔ na4[SN (OH)6]
Det finns också amphoteros -oxider från Gallien, indianen, skandio, titan, cirkonium, vanadin, krom, järnet, kobolten, koppar, silver, guld, germanio, antimon, bismut och telurio.
Anoter hydroxider
Hydroxider kan också presentera amfotenta egenskaper, till exempel i fall av aluminiumhydroxid och beryllium. Båda exemplen observeras nedan:
Aluminiumhydroxid som syra:
Al (OH)3 + 3HCL → ALCL3 + 3 timmar2ANTINGEN
Aluminiumhydroxid som bas:
Al (OH)3 + NaOH → Na [Al (OH)4]
Berylliumhydroxid som syra:
Vara (oh)2 + 2HCL → BECL2 + H2ANTINGEN
Berylliumhydroxid som bas:
Vara (oh)2 + 2NAOH → NA2[Vara (OH)4]
Skillnader mellan amphoteros, amfiprtiska, amfoliter och apraticics
Det är nödvändigt att veta hur man kan differentiera begreppet varje term, eftersom dess likhet kan bli förvirrande.
Det är känt att amfotoros är ämnen som uppför sig som syror eller baser i en reaktion som producerar ett salt och vatten. De kan göra detta för donation eller fångst av en proton, eller helt enkelt genom att acceptera ett elektroniskt vridmoment (eller ge det) enligt Lewis teori.
Å andra sidan är amfotiska ämnen de amphoters som fungerar som syror eller baser med donation eller insamling av en proton, enligt Bronsted-Lowrys lag. Alla amfotiska ämnen är amfotiska.
Kan tjäna dig: Benzoine: Struktur, egenskaper, användningar och riskerAmpolitiska föreningar är amfotenta molekyler som finns som zwitterioner och har dipoljoner i vissa ph -phyes. De används som dämpningsmedel i buffertlösningar.
Slutligen är Squeeze -lösningsmedlen de som inte har protoner att ge efter och inte kan acceptera dem heller.
Referenser
- Amfoter. (2008). Wikipedia. Erhållen från in.Wikipedia.org
- Anne Marie Helmestine, s. (2017). Vad betyder amfoteriskt i kemi?. Erhållet från Thoughtco.com
- Bicpuc. (2016). Amfoteriska föreningar. Erhållet från medum.com
- Kemikkolis. (s.F.). Definition av amfoterisk. Erhållet från Chemicool.com.

