Asparaginegenskaper, struktur, funktioner, biosyntes
- 2292
- 161
- Lars Eriksson
De Sparris (ASN eller N) är en viktig aminosyra för cellsignalering och föreningen mellan proteiner och kolhydrater. Detta är en av de 22 grundläggande aminosyrorna och katalogiseras som icke -essential, eftersom den syntetiseras av kroppen av däggdjur.
Denna aminosyran klassificeras i gruppen av polära aminosyror utan belastning och var den första nakna aminosyran, ett faktum som inträffade 1806, där den isolerades från sparrisjuice (en slags örtartad växt) av de franska kemikalierna Vauquelin och Robiquet.
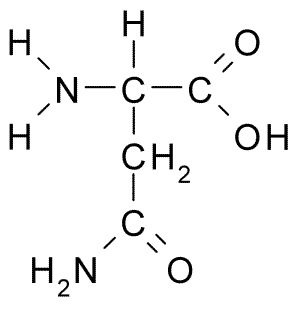
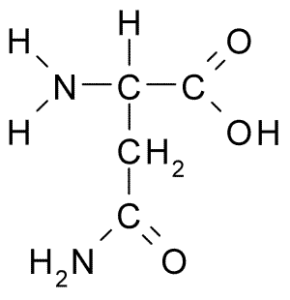 Kemisk struktur av aminosyrasparagin (källa: Borb, via Wikimedia Commons)
Kemisk struktur av aminosyrasparagin (källa: Borb, via Wikimedia Commons) Trots dess tidiga upptäckt erkändes inte den biologiska och näringsrollen av asparagin utan mer än 100 år senare när dess närvaro i strukturen hos ett protein som finns i hampfrönna bekräftades 1932 i strukturen hos ett protein som finns i hampfrön.
Asparagin och glutamin fungerar som substrat för de grupperna av två mycket frekventa aminosyror i proteiner: aspartisk (aspartinsyra) och glutamat (glutaminsyra) respektive. Asparagin och glutamin hydrolyseras lätt i dessa aminosyror av enzymatisk verkan eller syra och basföreningar.
Många proteas serinenzymer som är ansvariga för hydrolysering av peptidbindningar har asparagin i sidokedjan på deras aktiva ställe. Denna rest har en negativ partiell belastning och är ansvarig för att gå med på ett komplementärt sätt med den positiva belastningen av de vita peptiderna, närmar sig skärplatsen.
Det enzym som ansvarar för oxalacetatsyntesen från asparagin används vid kemoterapeutiska behandlingar och är känt som L-asparaginas, som är ansvarig för att katalysera den hydrolytiska fragmenteringen av amida av asparagin mot aspartat och ammonium.
Asparaginas är överuttryckt och renat från Escherichia coli, Att injiceras hos barnpatienter som har akut lymfoblastisk leukemi, eftersom både normala och maligna lymfocyter beror på fångst av asparagin i blodet för tillväxt och multiplikation.
[TOC]
Egenskaper och struktur
Alla kemiska strukturer i aminosyrorna har en karboxylgrupp (-COH), en aminogrupp (-NH3+), ett väte (-H) och en R- eller substituentgrupp som är förenade med samma centrala kolatom, känd som kol a.
Aminosyror skiljer sig från varandra genom identiteten på deras sidokedjor, som är de som är kända som R -grupper och som kan variera i storlek, struktur, funktionella grupper och till och med elektrisk laddning.
Kolatomer i R -grupper identifierar sig med bokstäver från det grekiska alfabetet. Således, i fallet med asparagin, identifieras kolhybonerna i R -kedjan som ß och y kolhydrater.
Kan tjäna dig: Agar XLD: Foundation, förberedelser och användningarEnligt en annan typ av nomenklaturer listas kolatomen i karboxylgruppen (-COH) som C-1, så att fortsätta med numreringen skulle kolet vara C-2 och så vidare.
En asparaginmolekyl har fyra kolatomer, inklusive kol a, karboxylgrupp kol och två kolatomer som ingår i R-gruppen, känd som karboxamid (-CH2-CO-CO-NH2).
Denna karboxamidgrupp finns endast i två aminosyror: i asparagin och glutamin. Det har karakteristiken att det kan bilda vätebroar med stor lätthet genom aminogruppen (-NH2) och karbonylgruppen (-CO).
Klassificering
Asparagin tillhör gruppen av polära aminosyror utan belastning, som är mycket lösliga aminosyror i vatten och mycket hydrofil (på grund av deras bildningskapacitet för flera vätebroar).
I gruppen polära aminosyror utan belastning är också serin, treonin, cystein och glutamin. Alla dessa är föreningar "Zwitterionics”, Eftersom de har en polär grupp i sin R -kedja som bidrar med neutraliseringen av belastningarna.
Alla polära aminosyror utan belastning är inte joniserbara i pH nära 7 (neutralt), det vill säga de har inte positiva eller negativa laddningar. I sura och grundläggande medier är emellertid substituenter joniserade och får en börda.
Stereokemi
Det centrala kolet eller a -kolet i aminosyrorna är ett chiralt kol, då har det fyra olika förenade substituenter, vilket orsakar minst två urskiljbara stereoisomerer för varje aminosyran.
Stereoisomerer är spekulära bilder av en molekyl som har samma molekylformel, men är inte superponabla med varandra, till exempel händer (vänster och höger). De betecknas med bokstaven D eller L, eftersom experimentellt lösningarna av dessa aminosyror roterar det polariserade ljusplanet i motsatta riktningar.
Den allmänna asymmetrin för aminosyror gör stereokemi för dessa föreningar av stor betydelse, eftersom var och en har olika egenskaper, syntetiseras och deltar i olika metaboliska rutter.
Asparagin finns i D-asparagin- eller L-asparaginformen, den senare är den vanligaste i naturen. Det syntetiseras av L-syntesas och metaboliseras för L-asparaginas, båda enzymerna är mycket rikliga i ryggradslevern.
Funktioner
Den enkla att bilda asparaginvätebroar gör det till en avgörande aminosyra för den strukturella stabiliteten hos proteiner, eftersom det kan bilda inre vätebroar med sidokedjorna hos de andra aminosyrorna som gör dem upp.
Kan tjäna dig: 25 exempel på asexuell reproduktionAsparagin finns vanligtvis på ytan av typiska vattenhaltiga medier, stabiliserar deras struktur.
Många glykoproteiner kan binda till kolhydrater eller kolhydrater genom en asparagin, treonin- eller serinrest. När det gäller asparagin förenas en acetylgalactosamin i allmänhet till aminogruppen genom n-glycycosylering.
Det är viktigt att lyfta fram att i alla N-glykosylerade glykoproteiner kolhydrater binder till dessa genom en asparaginrest som är i en specifik region betecknad som Asn-X-Ser/Thr, där X är någon aminosyra.
Dessa glykoproteiner monteras i endoplasmatisk retikulum, där de är glykosylerade när de översätts.
Biosyntes
Alla eukaryota organismer assimilerar ammoniak och förvandlar den till glutamat, glutamin, karbamilfosfat och sparris. Asparagin kan syntetiseras från glykolytiska mellanhänder, i citronsyran (från oxalacetat) eller från de föregångare som konsumeras i kosten.
Syntetasasparaginenzymet är ett amidotransferas som är beroende av glutamin och ATP att ATP och oorganiska pyrofosfat (PPI) spottar och använder ammoniak eller glutamin för att katalysera en amideringsreaktion och omvandla aspartatet till sparagin.
Både bakterier och djur har en syntetasasparagin, i bakterier använder emellertid enzymet ammoniumjonen som en kvävedonator, medan hos däggdjur använder syntetiken syntesas glutamin som huvuddonator för kvävegruppen.
Det enzymatiska brottet av ATP till AMP och oorganiskt pyrofosfat (PPI), tillsammans med glutamin som givare av Amida-gruppen, är de viktigaste skillnaderna med avseende på biosyntesen av L-glutamin mellan de olika organismerna.
Degradering
De flesta studier på asparaginmetabolism har genomförts i växter, med tanke på att studier på däggdjur initialt hindrades av bristen på metodologier tillräckligt känsliga för aminosyratester på nivån för mer komplexa system.
L-asparagin hydrolyseras ständigt hos däggdjur av L-asparaginas för att orsaka aspartinsyra och ammonium. Det används för syntes av glykoproteiner och är en av de viktigaste föregångarna till oxalacetat för citronsyran Cykeln.
Asparaginasenzym katalyserar asparaginhydrolys till aspartat, därefter aspartat transamineras med a-cetoglutarat för att producera glutamat och oxalacetat.
Kan tjäna dig: epiblastSyntheta asparagine, även känd som aspartat-amoniaco-ligas, finns rikligt med hjärnceller från däggdjur.
När låga nivåer av detta enzym uppfattas i kroppen, bildas det som kallas "aminoacidopatier", eftersom föregångssubstrat ackumuleras i cytoplasma av hjärnceller.
Livsmedel rika på sparris
Människor som har akut lymfoblastisk leukemi har vanligtvis brister med avseende på syntetasasparaginenzymet och beror på asparagin i omlopp, så de rekommenderas en diet i livsmedel som är rika på asparagin eller det exogena tillförseln av samma.
Bland de flera livsmedel med ett högt asparagininnehåll är hon.
Det finns L-asparaginkoncentrat som är formulerade för idrottare med hög konkurrens, eftersom deras konsumtion hjälper till att regenerera proteinerna som utgör vävnaderna.
Dessutom äter människor som har underskott i aminosyrasyntes också dessa tabletter för att undvika störningar i sitt centrala nervsystem.
Asparagin är lättare att metabolisera genom sin L-asparaginform, eftersom många av de enzymer som är involverade i deras ämnesomsättning inte känner igen D-asparaginformen och därför inte alla asparagin som intas i mat är tillgängliga för olika organismerprocesser.
Det rikliga sparrisintaget kan vara fördelaktigt, men det rekommenderas inte.
Referenser
- Cooney, D. TILL., Capizzi, r. L., & Handschumacher, r. OCH. (1970). Utvärdering av L-asparagine metabolism hos anims och man. Cancerforskning, 30 (4), 929-935
- Dunlop, s. C., Roon, r. J., & Jämn, h. L. (1976). Användning av D-asparagin av Saccharomyces cerevisiae. Journal of Bacteriology, 125 (3), 999-1004.
- Kambhampati, s., Ajewole, E., & Marsolais, f. (2017). Framsteg inom asparaginmetabolism. I Framsteg i botanik Vul. 79 (sid. 49-74). Springer, Cham.
- Kornfeld, r., & Kornfeld, s. (1985). Montering av sparrisbundna oligosackarider. Årlig översyn av biokemi, 54 (1), 631-664
- Mathews, C. K., & Ahern, K. G. (2002). Biokemi. Pearson Education.
- Nelson, D. L., Lehninger, a. L., & Cox, M. M. (2008). Lehninger principer för biokemi. Macmillan.
- Yamada, k., Hashizume, D., Shimizu, T., & Yokoyama, s. (2007). L-asparagin. Kristallagel Avsnitt E: Strukturrapporter online, 63 (9), 3802-3803.

