Kaliumbiftalatstruktur, nomenklatur, användningar, risker
- 3087
- 636
- PhD. Lennart Johansson
han kaliumbiftalat Det är en kemisk, solid, vit, löslig förening, som är kommersiellt i hög renhetstillstånd. Det används som ett primärt mönster för att standardisera lösningar i syrabasskvalifikationer; Det används också som en buffertlösning för att hålla lösningens pH.
Det är en stabil, icke -hygroskopisk förening, som underlättar framställningen av lösning eftersom den inte absorberar vatten under den tunga processen. Det kan framställas genom reaktionen mellan fotalsyra och en KOH -lösning, där ett väte av ftalinsyramolekylen ersätts av en kaliumatom.
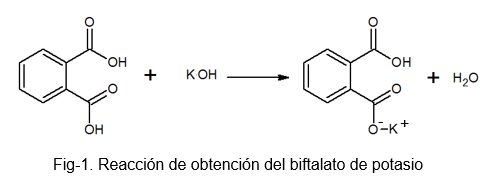
Kaliumbifttalat får detta namn eftersom det i dess molekyl finns något surt väte. Detta väte är den som finns i -OH -gruppen som ligger bredvid karbonylgruppen, som är en del av karboxylen som inte reagerar. Denna typ av salter kallas syrasalter, eftersom de inte är helt neutrala.
[TOC]
Kemisk struktur

Formel
C6H4Coohcook = c8H5 Ko4
Nomenklatur
- Kaliumbiftalat.
- Kaliumsyratalat.
- Kaliumhydrogenoftalat.
Egenskaper
Densitet
1 636 g/ml.
Molmassa
204.22 g/mol.
Löslighet
Vatten och alkohol.
Smältpunkt
295 ° C med nedbrytning.
Aspekt
Vit -till -vit fast.
Spännande vikt
1,64 gr/cm3.
Kaliumbiftalatderivatstudie
Derikrografiska mätningar har visat att nedbrytningen av kaliumbifttalat börjar mellan 190 ° C och 200 ° C, och icke -hygroskopisk beredning kan framställas mellan 100 ° C och 150 ° C.
Nedbrytningen fortsätter i tre steg, vars hastighet beror på hastigheten i ökningen av temperaturen: Dipbotassiumftalatet bildas först, den faliska anhydriden och vattnet elimineras.
Kan tjäna dig: kalciumklorid (CaCl2)Entalpía -förändringar kan också erhållas från derivatet, detta ger information om den ytterligare mekanismen för termisk nedbrytning och förändringar i provets tillstånd.
Användning och applikationer
Denna förening används i analytisk kemi i syrabasen titrering eller bedömning som ett primärt mönster för standardisering vid framställning av lösningar från olika föreningar.
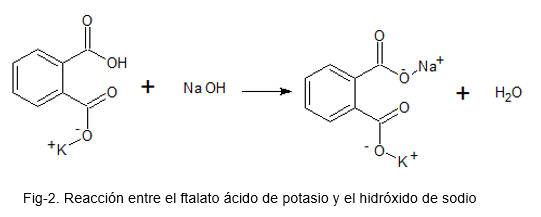
Standardisering av en bas (alkali = NaOH)
Vid framställning av en NaOH -lösning kan det inte garanteras att koncentrationen med vilken lösningen återstår är korrekt; Detta beror på att NaOH är ett mycket hygroskopiskt fast ämne (absorbera luft från luften), och för att väga den kvarstår den med viss fukt, vilket gör mängden substans inte den mest optimala.
När lösningen är beredd är det nödvändig att veta exakt vilken koncentration den har kvar.
För detta framställs en lösning med kaliumsyra ftalat, vilket är ett primärt mönster (på grund av dess höga stabilitet); Några droppar fenolftalinsyra-basindikator läggs till och NaOH-lösningen som en titel läggs till tills en rosa färg hålls närvarande i kaliumsyran ftalatlösning.
Med de erhållna uppgifterna görs de relevanta beräkningarna för att hitta den verkliga koncentrationen av NaOH.
Följande bild illustrerar den kemiska reaktionen mellan kaliumsyratalat och natriumhydroxid.

Som en buffertlösning i bestämningen av pH
En buffert- eller buffertlösning är den som bildas av både syra- och syrasalt, vilket gör att den förblir i förhållanden så att pH -värdet inte förändras när små mängder syra eller bas läggs till.
Kan tjäna dig: gravimetri: gravimetrisk analys, metoder, användningar och exempelRisker
- Brandexponering. Som med de flesta organiska fasta ämnen är det möjligt att eld vid höga temperaturer eller genom kontakt med en tändningskälla kan förekomma.
- Det fina dammet spridd i luften i tillräckliga koncentrationer, och i närvaro av en tändningskälla är en potential för farlig dammexplosion.
- Det är ett stabilt ämne vid rumstemperatur och i adekvata lagringsförhållanden. Överdriven värme och fukt bör undvikas.
- Det kan vara oförenligt med starka oxidanter som salpetersyra.
- Nedbrytning kan bilda koloxider som är giftiga.
Angående hälsa
- Genom oavsiktligt intag kan det orsaka kräkningar, diarré och irritation i membranen på grund av deras surhet.
- Genom inandning orsakar det irritation i luftvägarna och hosta.
- I huden orsakar det irritation.
- I ögonen orsakar det irritation, rodnad och smärta.
- Det anses att det inte är ett cancerframkallande, teratogena eller mutagena substans.
Nödsituation och första hjälpen
- Tvätta ögonen med mycket vatten, ta bort bromsning vid transportering av dem och låt vattnet rinna genom ögonen utan att bli berörda med händerna.
- Om det fanns kontakt med huden, ta bort kostymer och skor, tvätta med mycket vatten och tvätta plaggen mycket bra innan du använder igen.
- Vid intag, undvik att provocera kräkningar, dricksvatten.
- Vid inandning, ta personen att andas frisk luft; Vid svår andetag, leverera syre.
- I alla fall begär brådskande medicinsk hjälp.
- Vid läckor eller spill, samla in produkten i en ren behållare och försök att göra dammet inte spridd.
Det kan tjäna dig: Vilka är de negativa effekterna vi har med vattenlöslighet?Personliga skyddsåtgärder
- Håll dig borta från den plats där drycker, mat och foder lagras (husdjursmat).
- Använd anti -dammmasker, neopren eller PVC -handskar. För närvarande används nitrilhandskar.
- Bär adekvata kläder som täcker det mesta av kroppen, inklusive täckta stövlar eller sko- och säkerhetsglasögon.
- Lokal avgasventilation rekommenderas, med luftekstraktsystem, med hänsyn till den dominerande vindriktningen.
- Produkten är blandbar i vatten, den absorberas inte på marken, den är inte bioakumulerbar eller biologiskt nedbrytbar, den förväntas inte påverka vattenlevande liv. Men vid tidpunkten för att kassera det måste det göras med hjälp av specialiserad personal: Kassera inte av avlopp.
- Förvara i orange/grönt område, färskt torrt och ventilerat ställe och separeras från inkompatibelt material.
Referenser
- Merck, (s.f), Merckmillipore.com
- Chang R.,(1992), kemi, (fjärde upplagan), Mexiko, McGraw-Hill Inter-American från Mexikos.A, från c.V
- Meyer kemi reagens, (s.f), säkerhetsdatablad, kaliumbiftalat, återhämtat sig från, reagentsmeyer.com.mx
- Belcher, r.,Erdey, l.,Paulik, f.,Liptay.G.,(Juli 1960), Kaliumhydrogenoftateftalatbrand, Vetenskaplig, Volym 5, nummer 1, Sidorna 53-57, org/10.1016/0039-9140 (60) 80205-6

