Boraxhistoria, struktur, egenskaper, användningar, syntes, risker

- 2549
- 405
- Johan Gustafsson
han Borax eller natriumborat Det är ett valör för en grupp kemiska föreningar med en basformel av NA2B4ANTINGEN7. Det är ett hygroskopiskt salt som kan bilda många hydrater, förutom att strukturellt berika sig genom närvaron av vissa metallföroreningar.
De viktigaste föreningarna som kallas borax är följande: anhydro natriumtetreboryr, NA2B4ANTINGEN7; Pentahydrat -natriumtetreboryr (NA2B4ANTINGEN7).5 timmar2ANTINGEN; och natriumtetaborate, NA2B4ANTINGEN7.10 timmar2Eller, eller motsvarande, octahydrat -natriumtetreboryret, NA2B4ANTINGEN5(ÅH)4.8h2ANTINGEN.
 Boraxfragment. Källa: Leon Hupperichs [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Boraxfragment. Källa: Leon Hupperichs [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] Som framgår skiljer sig alla tidigare fasta ämnen endast i sin hydreringsgrad; Vissa har fler vattenmolekyler i sina kristaller än andra. Fysiskt Borax liknar bitar eller robusta kritkristaller (överlägsen bild).
Naturligtvis finns Borax i sediment av säsongens sjöar, torkad av indunstning. Borax förekommer i Turkiet, Searles Lakes (Kalifornien), i Atacama, Chile, Bolivia, Tibet och Rumänien öken. Syntetiskt kan boraxkristaller erhållas genom en långsam kärnbildningsprocess; det vill säga en där kristallernas tillväxt gynnas.
Natrium, vattenfri och dechaydratiserad tetreboryr är lite lösliga i kallt vatten; Men dess löslighet ökar med en temperaturökning. Då en2B4ANTINGEN7.10 timmar2Eller det är mycket lösligt i etylenglykol, måttligt löslig i etanol och lite lösligt vid aceton; Dessa är mindre polära lösningsmedel än vatten.
Borax har många applikationer, till exempel i utarbetandet av tvättmedel och tvålar; som en fördröjare av elden av det cellulosa materialet; i glasfiberproduktion; vid rengöring av hårda ytor såsom metaller, glas och keramik; och i korrosionsinhibering, bland andra användningsområden.
Borax är irriterande för ögon, hud och luftvägar. Genom förtäring kan det bland annat producera symtom, kräkningar, diarré, slapp, förfall och anfall. Det misstänks för närvarande att skadliga effekter på mänsklig reproduktion kan ha.
[TOC]
Historia
Boraxens historia är förvirrande. Det påpekas att det upptäcktes i sängen av en Tibetsjö, torkad av indunstning. Det överfördes under det sjunde århundradet av Tibet till Saudiarabien, efter den så kallade sidenvägen.
Termen "Borax" var populär efter de många applikationer som hittades och marknadsfördes under namnet 20 Mule Team Borax Tradermax, som hänvisade till hur Borax transporterades genom öknarna i Nevada och Kalifornien.
En annan version av deras upptäckt indikerar att egypterna hade känt för sin existens under lång tid och använde den i svetsarna av metaller med värme. Dessutom använde de det inom medicin och i mumifieringsprocessen. Borax överfördes till Europa under trettonhundratalet av Marco Polo.
I mitten av nittonhundratalet upptäcktes stora boraxavlagringar i Magove -öknen, vilket gjorde att dess användning var vanlig sedan dess.
Borststruktur
 Boraxjonstruktur. Källa: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]
Boraxjonstruktur. Källa: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] Den överlägsna bilden visar jonerna som utgör boraxen, särskilt motsvarande ett fast ämne med en kompositionsformel av NA2[B4ANTINGEN5(ÅH)4] · 8h2Eller (eller na2B4ANTINGEN7· 10 timmar2ANTINGEN).
Först kan den burade strukturen hos anjonen märkas [b4ANTINGEN5(ÅH)4]2- (Även om jag borde ha två grupper-), där en åttkantig ring (fyra atomer av B och fyra av O) kan ses), med en B-O-B-bro som delar upp den i två halvor.
Kan tjäna dig: Alkalina lösningar: Definition, egenskaper och användningarDenna bur förblir inte statisk, men vibrerar och antar olika konformationer i rymden; Men i mindre utsträckning i närheten av bron. Det kan också märkas att det är mycket "syresatt"; Det vill säga det har många syreatomer, som kan interagera med vattenmolekyler med vätebroar.
Det är inte förvånande att boraxkristaller kan hydrera och generera många hydrater. Således för den fasta NA2[B4ANTINGEN5(ÅH)4] · 8h2Eller det finns åtta timmar molekyler2Eller interagera med boratburen och samtidigt med metallcentra i NA+.
På katjonssidan har du det vattenhaltiga komplexet [na (h2ANTINGEN)4]+n, där värdet på n beror på anjon/katjonandel. I det övre fasta ämnet, n = 2, så du har: [na2(H2ANTINGEN)8]2+, vars belastning 2+ neutraliserar belastningen 2- av boratjonen.
Kristaller
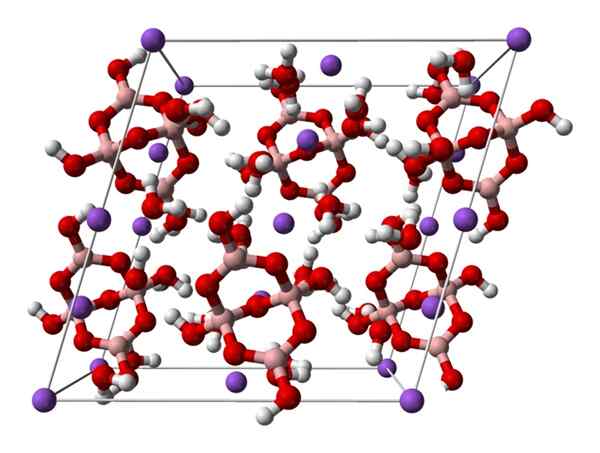 Boraxmonoklinisk cell. Källa: Ben Mills [offentligt
Boraxmonoklinisk cell. Källa: Ben Mills [offentligtDomän].
Upp2[B4ANTINGEN5(ÅH)4] · 8h2Eller na2B4ANTINGEN7· 10 timmar2ANTINGEN. Här elektrostatiska attraktioner och vätebroar styr eller dominerar de strukturella mönstren som har sitt ursprung i varje glas av glaset.
Andra hydrater och vattenfritt salt förlorar en eller alla sina vattenmolekyler och förändrar Borax Crystalens sammansättning och struktur. I dem alla förblir anjon och katjon densamma (såvida det inte finns föroreningar eller sidoreaktioner), så förvirring kan inte genereras.
Förvirringar med boraatoanjonen
Na2[B4ANTINGEN5(ÅH)4] · 8h2Eller och na2B4ANTINGEN7· 10 timmar2Eller de är desamma. Därför att?
Först, om deras atomer räknas, kommer de att se att de sammanfaller i antal; Och för det andra, i anjon B4ANTINGEN72- Frånvaron av de två OH-grupperna som är kopplade till borhuvudena på B-O-B-broarna beaktas; två åh det, tillsammans med de två h+ från B4ANTINGEN72-, Lägg till upp till 2 timmar2Eller ger totalt 10 timmar2O (8 + 2).
Egenskaper
Namn
- Borax.
- Natriumborat.
- Natriumtetrålat.
- Tetrålit.
Molekylär massa
Anhydro: 201,22 g/mol.
Decohydrat: 381,38 g/mol.
Fysiskt utseende
Ett kristallint vitt fast ämne.
Densitet
Vattenfri: 2,4 g/cm3
Decahixture: 1 739 g/cm3
Smältpunkt
Anhidro: 743 ºC (1.369 ºF, 1.016 K).
Decohydrat: 75 ºC.
Kokpunkt
Anhidro: 1.575 ºC (2.867 ºF, 1.848 K).
Vattenlöslighet
31,78 g/l (både för vattenfri och förekommande).
Löslighet i organiska lösningsmedel
Det är mycket lösligt i etylenglykol, måttligt lösligt i dietylenglykol och metanol och något lösligt i aceton.
Brytningsindex (ηd)
Anhidro: η1 = 1 447; η2 = 1 469.
FörfallnaDrado: η2 = 1 472.
Stabilitet
Det är stabilt under adekvata lagringsförhållanden. Även om det har ett lågt ångtryck ökar det med temperaturen, vilket orsakar kristallisation och kondensation, så överdriven temperatur och fuktfluktuationer bör undvikas.
Lättutsläpp
Natriumtetreboryret när den utsätts för brandens verkan avger ett grönt ljus.
Reaktioner
- Vid upplösning i vattnet har alkaliska lösningar härstammar med ett pH runt 9.2.
- Borax reagerar för att bilda andra borater, såsom perborate (PBS).
- Det producerar också borsyra när man reagerar med saltsyra:
Na2B4ANTINGEN7· 10 timmar2O + hcl => 4 h3Bo3 + 2 na+ + 2 Cl- + 5 h2ANTINGEN
- Natriumtoraboraten uppför sig som ett amfete -substans, eftersom den i vattenlösning är hydrolyserad och kan neutralisera syra. På samma sätt kan den neutralisera alkalier med hög koncentration och undvika överdriven höjd av medium pH.
Kan tjäna dig: primär alkohol: struktur, egenskaper, nomenklatur, exempelAnsökningar
Borax har många tillämpningar, både i människan och i den uppsättning aktiviteter som den utför.
Antioxidantverkan
Borax har förmågan att lösa oxider. Av denna anledning används den vid återhämtning av metaller som mässing, koppar, bly och zink.
Det används också för att förhindra oxidation av metallstänger i grunden. Borax täcker ytan, exklusive luften och därför undviker oxidation. Dessutom förhindrar det korrosion av järnmaterial vid biltillverkning.
Borax -löslighet i etylenglykol har varit användbar i frostskyddsformuleringar. Borax neutraliserar det sura avfallet som produceras under nedbrytningen av etylenglykol, vilket minimerar oxidationen som ytan på metaller kan drabbas.
Utarbetande av lim
- Borax är en del av en självhäftande stärkelseformulering för korrugerat papper och kartong.
- Det är ett peptiserande medel vid tillverkning av lim baserat på kasein och dextrin.
- Handlingar som förstärker limmaterial genom att korsa de konjugerade hydroxils -grupperna.
Brandskyddsmedel
Det används som brandhämmande medel i cellulosa material och andra polymerer som innehåller hydroxilligrupper. Det utövar sin verkan genom flera mekanismer, inklusive bildandet av ett glasskikt som begränsar åtkomsten av bränslen.
Borosiliserat glasutarbetande (Pyrex)
Borax är en källa till bor som används vid utarbetandet av borosiliserat glas; kännetecknas av en hög fusionspunkt, låg expansionskoefficient och hög motstånd mot termiska stötar.
Detta gör att du kan bli föremål för höga temperaturer utan att uppleva frakturer, få det eldfasta glas valöret.
Borosiliserat glas används i utarbetandet av material som ska användas hemma för att baka mat. Det används också i laboratorium i Beaker, Fixolas, mäter cylindrar, pipetter, etc.
Emulgeringsmedel
Borax, tillsammans med andra föreningar, används för att emulgera tvålar och andra paraffiner. Det används också som grund för utarbetande av lotioner, krämer och salvor.
Städmaterial
- Det läggs till i formuleringarna för att rengöra fasta ytor som metaller, glas och keramik.
- Det används i handrengöringsmedel, poleringsmaterial och tvättmedelssålar i tvättstugor och hem. Dessutom underlättar det avlägsnande av oljiga avlagringar från golven i fabrikerna.
Medicinsk användning
- Det används vid behandling av fötter svampinfektioner.
- Det är en del av näringsformeln som levererar bor. Detta element tros ingripa i metabolism för kalcium, fosfor och magnesium, som är nödvändigt för benstruktur.
- Det ingriper i bestämningen av glykosylerat hemoglobin (HBA1C), bevis som tjänar till att veta utvecklingen av långvarig diabetes hos en patient, eftersom halva livstiden för en erytrocyt är 120 dagar.
Denna information är mer användbar för läkaren än isolerade bestämningar av patientens blodglukos.
PH -stötdämpare
Det används i flera pH -stötdämpare som används i biokemi; Bland dem används Tris (hydroximetyl) aminometan-bor, som används vid elektrofores i polyakrylamid av DNA och RNA-nukleinsyror.
Minskning av vattenhårdheten
Borax kan kombinera med kalcium- och magnesiumjoner närvarande i vattnet, vilket minskar dess koncentration. På detta sätt reduceras hårdheten hos vatten.
Kan tjäna dig: kaliumhydroxid: struktur, egenskaper, användningarGödningsmedel och gödningsmedel
Borax används som en källa till bor. Kalcium och bor är involverade i bildandet av växternas cellvägg. Dessutom har det påpekats att bor gynnar pollinering, så den ingriper i befruktningen och spridningen av växter.
Träbevarande
Borax kämpar mot Woodwood, en skalbagge som konsumerar och förstör träet. Det används också vid bevarande och underhåll av träfartyg.
Grundande och flöde
Det används som grundare inom stål- och järnsvetsning, vilket orsakar en minskning av smältpunkten och eliminering av järnoxid; Ett oönskat förorenande. Med ett liknande slut deltar det i svetsningen av guld och silver.
Andra
- Det används som en mjuk bekämpningsmedel; Till exempel för strid av malar i ull.
- Sprayade serverar för kontroll av skadedjur som finns i skåp, inre avlagringar, i väggarnas luckor, och i allmänhet, där användningen av mer förorenande bekämpningsmedel inte önskas.
- Det används i kärnreaktorer för att kontrollera reaktioner som i extrema fall kan ge en kedjereaktion.
- I bilar radiatorer används borax för att få platserna där det finns vatten fly.
Syntes
Borax erhålls genom React5ANTINGEN9.8h2Eller, med natriumkarbonat och natriumhydrokarbonat i vattenhaltigt medium.
Egentligen används syntesen av natrium- eller boraxtetreboryr lite; De flesta av den producerade föreningen erhålls genom dess extraktion av mineralerna som innehåller den.
Processen kan sammanfattas i en lösning av malmen i vatten, följt av en lerafiltrering och slutligen en indunstning av den vattenhaltiga lösningen.
Risker
Borax är en naturlig produkt, men den kan ge en serie hälsoskador hos människor. På grund av kontakt med dammet kan till exempel en irritation av huden som kan orsaka dermatit uppstå.
På samma sätt producerar Borax irritation i ögonen och övre luftvägarna. Bland symtomen på inandning finns det hosta och halssmärta.
Samtidigt presenterar boraxintaget följande symtom: kräkningar, illamående, diarré, sagging, huvudvärk och anfall. Dessutom kan en påverkan av centrala nervsystemet och njurfunktionen inträffa.
Från studier som utfördes i manliga -sex -råttor, matade med borax, observerades testikelatrofi. Medan studier genomförda med gravida kvinnliga råttor påpekade att Borax kunde korsa moderkakan och producera en förändring av fosterutvecklingen, manifesterades av låg födelsevikt.
Det tros att Borax -exponering kan påverka manlig reproduktionsfunktion hos människan, manifesterad av en minskning av spermierräkningen.
En dödlig dos på 10 till 25 gram uppskattas för Borax -intag hos vuxna.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Nationellt centrum för bioteknikinformation. (2019). Argon. Pubchemdatabas. CID = 23968. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Karolyn Burns, Seneca Joseph, & Dr. Ryan Baumbach. (s.F.). Syntes och egenskaper hos boraxkristaller och intermetallliska legeringar. Återhämtat sig från: NationalMaglab.org
- Wikipedia. (2019). Borax. Hämtad från: i.Wikipedia.org
- Rio tinto. (2019). Borax dehydrat. 20 Mule Team Borax. Återhämtat sig från: borax.com
- Fletcher jenna. (14 januari 2019). Är borax säkert att använda? Återställt från: MedicalNewStody.com
- « Kromklorid (CRCL3) struktur, egenskaper, användningar
- Transgena mategenskaper, fördelar, exempel, konsekvenser »

