Litiumbromidstruktur, egenskaper, användningar, risker
- 2402
- 9
- Johan Gustafsson
han Litiumbromid Det är ett neutralt salt av en alkalisk metall vars kemiska formel är libr. Formeln uttrycker att dess kristallina fasta ämnen består av lijoner+ och br- I ett 1: 1 -förhållande. Dina kristaller är vita eller lätta beige. Det är mycket lösligt i vattnet och det är också ett ganska hygroskopiskt salt.
Denna sista egenskap tillåter dess användning som torkmedel i luftkonditionering och kylsystem. Likaså användes litiumbromid sedan början av 1900 -talet vid behandling av vissa psykiska hälsoproblem och övergav dess användning på grund av olämplig användning av salt.
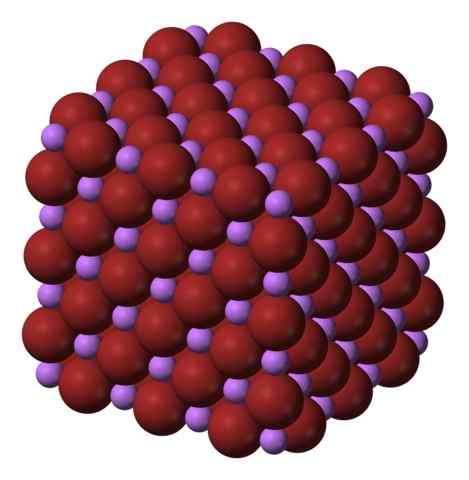
 Kubisk kristallin struktur i libren. Källa: Benjah-Bmm27 via Wikipedia.
Kubisk kristallin struktur i libren. Källa: Benjah-Bmm27 via Wikipedia. Libr produceras genom behandling av litiumkarbonat, LI2Co3, med bromhyterinsyra. Efter uppvärmning av mediet, fäller ut i den vattenhaltiga lösningen som ett hydrat.
Detta salt irriterar huden och ögonen genom kontakt, samtidigt som den producerar irritation av andningsskanaler genom inandning. Intaget av litiumsalter kan orsaka illamående, kräkningar, diarré och yrsel.
[TOC]
Litiumbromidstruktur
Libr -formeln gör det klart att andelen Li/BR är lika med 1; För varje katjon+ Det måste finnas en br -anjon- motsvarighet. Därför måste denna andel hållas konstant i varje hörn av libr -kristallen.
Jonerna li+ och br- De lockar varandra och minskar avvisningarna mellan lika belastningar för att orsaka en kubisk kristalltyp av pärla; Detta är isomorfisk till NaCl (överlägsen bild). Observera att hela uppsättningen har en kubisk geometri.
I denna kristall, Li+ De är mindre och har en lätt violett färg; Medan BR- De är mer skrymmande och en intensiv brun färg. Det observeras att varje jon har sex grannar, vilket är detsamma som att säga att de presenterar en oktaedral samordning: libr6 eller li6Br; Men om den enhetliga cellen beaktas förblir andelen Li/BR 1.
Kan tjäna dig: kristallin strukturDetta är den kristallina strukturen som antagits företrädesvis av libren. Det kan emellertid också bilda andra typer av kristaller: Wurzita, om de kristalliseras vid låga temperaturer (-50 ° C) på ett underlag; o Kubikcentrerad på kroppen eller CSCL -typen, om det kubiska glas saltet utsätts under högt tryck.
Hydrater och glas
Ovanstående är tillämpligt för libr som är vattenfri. Detta salt är hygroskopiskt och kan därför absorbera miljöfuktigheten och blandar vattenmolekyler i sina egna kristaller. Således uppstår libr · nh hydrater2Eller (n = 1, 2, 3 ..., 10). För varje hydrat är den kristallina strukturen annorlunda.
Till exempel bestämde kristallografiska studier att libr · h2Eller anta en perovskita -typstruktur.
När dessa hydrater är i vattenlösning kan de flyta över och förorsakas sig själva; Det vill säga de antar en kristallin, men molekylär oordninglig struktur. Under sådana förhållanden blir vattenvätebroar ganska viktiga.
Egenskaper
Molekylvikt
88 845 g/mol.
Utseende
Vit kristallint fast eller lätt beige.
Lukt
Toalett.
Smältpunkt
552 ºC (1.026 ºF, 825 K).
Kokpunkt
1.256 ºC (2.309 ºF, 1.538 K).
Vattenlöslighet
166,7 g/100 ml vid 20 ° C. Notera din höga löslighet.
Löslighet i organiska lösningsmedel
Löslig i metanol, etanol, eter och aceton. Något lösligt i pyridin, aromatisk förening och mindre polar än de tidigare.
Brytningsindex (ηd)
1 784.
Kaloriförmåga
51,88 j/mol · k.
Standard molär entropi (sθ 298)
66,9 j/mol · k.
antändningspunkt
1.265 ºC. Anses vara icke -flammbar.
Stabilitet
Stabil. Anhydraformen är emellertid extremt hygroskopisk.
Sönderfall
När det sönderdelas genom att värma orsakar det litiumoxid.
Kan tjäna dig: klorogensyrapH
Mellan pH 6 och 7 i vattenlösning (100 g/L, 20 ºC).
Reaktivitet
Litiumbromid är inte reaktiv under normala miljöförhållanden. Du kan dock uppleva intensiva reaktioner med starka syror när temperaturen ökar.
När man upplöses i vatten ökar temperaturen, orsakad av en negativ entalpi av hydratisering.
Produktion
Libr uppstår genom att reagera litiumhydroxid eller litiumkarbonat med bromhyterinsyra i en neutraliseringsreaktion:
Li2Co3 + Hbr => libr +co2 + H2ANTINGEN
Litiumbromid erhålls som ett hydrat. För att få vattenfri form är det nödvändigt att värma det hydratiserade saltet under vakuum.
Nomenklatur
Namnet 'litiumbromid' härrör från att vara en metallisk halogenid, namngiven enligt lager nomenklaturen. Andra namn, lika giltiga men mindre använda, är litiummonobromure, enligt den systematiska nomenklaturen; och den litiska bromiden (den unika valensen av +1 för litium), enligt den traditionella nomenklaturen.
Ansökningar
Torkmedel
Libr är ett hygroskopiskt salt och bildar en koncentrerad saltlösning som kan absorbera luftfuktighet i ett brett spektrum av temperaturer. Denna saltlösning används som torkmedel i luftkonditionerings- och kylsystem.
Fiber
Det används för att öka volymen av ull, hår och andra organiska fibrer.
Farmaceutiska addukter
Libr -forskarna med vissa farmaceutiska föreningar och modulerar dess verkan. En addukt är kombinationen genom att samordna två eller flera molekyler, utan en strukturell förändring av någon av United -molekylerna.
Lugnande
Litiumbromid användes i början som lugnande medel vid vissa psykiska störningar, sluta använda 1940. För närvarande används litiumkarbonat; Men i alla fall är litium det element som utövar den terapeutiska verkan i båda föreningarna.
Det kan tjäna dig: Plumbose Oxide (PBO): Formel, egenskaper, risker och användningarLitium används vid behandling av bipolär störning, efter att ha varit användbar vid kontrollen av maniska episoder av störningen. Litium tros hämma aktiviteten hos excitatoriska neurotransmittorer, såsom dopamin och glutaminsyra.
Å andra sidan ökar aktiviteten hos det hämmande systemet medierat av neurotransmitteren Gamma-amino-butiksyra (GABA) (GABA). Dessa åtgärder kan vara en del av grunden för litiumens terapeutiska verkan.
Risker
Kontaktoxicitet
Kutan irritation och sensibilisering, allergier. Allvarliga ögonskador eller ögonirritation, på luftvägarna, näsborren och halsen.
Intag
De viktigaste symtomen på grund av litiumbromidintag är: gastrointestinala störningar, kräkningar och illamående. Andra negativa effekter på saltintag inkluderar agitation, spasmer och förlust av medvetande.
Tillståndet känt som "bromism" kan uppstå med litium -bromiddos större än 225 mg/dag.
I bromismen kan några av följande symtom och tecken uppstå: förvärring av akne och aptitlöshet, skakningar, talproblem, apati, svaghet och maniacal agitation.
Referenser
- Kemisk formulering. (2019). Litiumbromid. Återhämtad från: Quimica -formulering.com
- David C. Johnson. (10 juli 2008). Ny ordning för litiumbromid. Natur. doi.org/10.1038/454174A
- Aayushi jain & r.C. Dixit. (s.F.). Strukturell fasövergång i litiumbromid: Effekt av tryck och temperatur. [Pdf]. Återhämtat sig från: NCPCM.i
- Takamuku et al. (1997). Röntgendiffraktionsstudier på superkyld vattenhaltig litiumbromid och litiumjodidlösningar. Institutionen för kemi, fakulteten för vetenskap, Fukuoka University, Nanakuma, Jonan-Ku, Fukuoka 814-80, Japan.
- Nationellt centrum för bioteknikinformation. (2019). Litiumbromid. PubChem -databas, CID = 82050. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Wikipedia. (2019). Litiumbromid. Hämtad från: i.Wikipedia.org
- Royal Society of Chemistry. (2019). Litiumbromid. Tanka. Återhämtat sig från: chemspider.com
- « Alkyl Halogenuros -egenskaper, erhållning, exempel
- Mexiko i 1700 -talets handlingar och socioekonomiska förändringar »

