Alkyl Halogenuros -egenskaper, erhållning, exempel
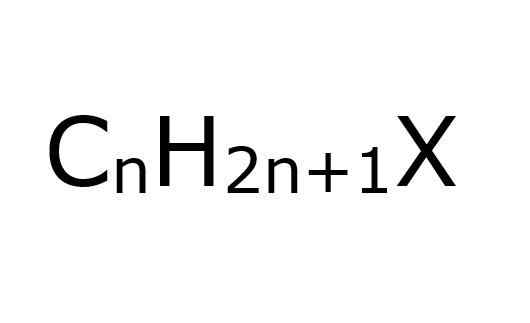
- 2601
- 211
- Prof. Erik Johansson
De alkylhalogenuro De är organiska föreningar där en kolatom med SP -hybridisering3 En halogen är kopplad kovalent (F, CL, BR, I). Ur ett annat perspektiv är det bekvämt att förenkla, anta att de är haloalcanos; Dessa är, för de som har ersatts några H -halogenatomer.
Som namnet antyder måste halogenatomer också kopplas till alquiliska grupper, R, för att betraktas av denna typ av halogenid; Även om de strukturellt kan ersättas eller grenas och ha aromatiska ringar och fortsätter fortfarande att vara en alkylhalogenid.
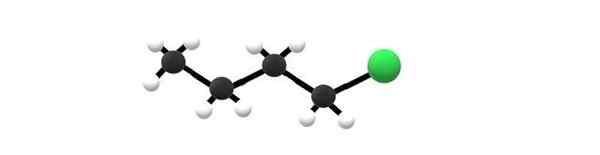 1-klorbutanmolekyl, ett exempel på en alkylhalogenid. Källa: Gabriel Bolívar.
1-klorbutanmolekyl, ett exempel på en alkylhalogenid. Källa: Gabriel Bolívar. Ovan har du 1-klorbutanmolekylen, som motsvarar en av de enklaste alkylhalogeniderna. Det kan ses att alla deras kol har enkla bindningar och också har SP -hybridisering3. Därför är den gröna sfären, motsvarande atomen i CL, kopplad till ett skelett härrörande från butanen alkan.
Exempel ännu enklare än 1-klorbutan är de härrörande från metangas: det minsta kolvätet av alla.
Från sin Cho -molekyl4 Du kan ersätta H -atomer med, för att säga, jod. Om en H byts ut kommer ch3I (yodometan eller metyljodid). När två timmar byts ut kommer CH att vara2Yo2 (Diyodometan eller metylenjodid). Följde och slutligen ersätter jag alla H ger chi3 (jodoform) och CI4 (Carbon Tetrayoduro).
Hyra halogenuros kännetecknas av att vara mycket reaktiv och med de mest elektronegativa atomerna i det periodiska bordet är det intuiterat att genom mekanismer symfiner utövar ett inflytande på biologiska matriser.
[TOC]
Alkylhalogenuros egenskaper
Egenskaperna för denna familj av föreningar beror på dess molekylstrukturer. Men jämfört med deras alkaner, anmärkningsvärda skillnader orsakade av det enkla faktumet i det finns C-X-länkar (x = halogenatom).
Det vill säga C-X-länkar är ansvariga för någon skillnad eller likhet mellan en eller flera alkylhalogenuros.
Till att börja med är C-H-länkar nästan apolära, med tanke på den låga elektronegativitetsskillnaden mellan C och H; Istället har C-X-länkar ett permanent dipolmoment, eftersom halogener är mer elektronegativa än kol (särskilt fluor).
Å andra sidan är vissa halogener lätta (F och CL), medan andra är tunga (BR och I). Dess atommassor formar också skillnader inom C-X-länkar; Och i sin tur, direkt i halogenidens egenskaper.
Därför är att lägga till halogener till ett kolväte lika med att öka dess polaritet och molekylmassa; Det är detsamma att göra det mindre flyktigt (till viss del), mindre brandfarligt och öka dess kokning eller fusionspunkter.
Kokning och fusionspunkter
Ovanstående visas, i ökande ordning, storleken och därför vikten av de olika halogenerna:
F < Cl < Br < I
Då förväntas det att alkylhalogenider som innehåller F -atomer är lättare än de som har atomer av BR eller I.
Till exempel beaktas vissa halogenuros härrörande från metan:
Ch3F < CH3Kli < CH3Bras < CH3Yo
Ch2F2 < CH2Kli2 < CH2Bras2 < CH2Yo2
Och så vidare för den andra derivatprodukten från en högre halogeneringsgrad. Observera att ordningen upprätthålls: Fluorinhalogenuros är lättare än jod. Inte bara det, utan också dess kokande och fusionspunkter följer också denna ordning; RF koka vid lägre temperaturer än RI (R = Cho3, för det här fallet).
Kan tjäna dig: aromatisk elektrofil substitution: mekanism och exempelPå samma sätt är alla dessa vätskor färglösa, eftersom elektronerna i sina C-X-bindningar inte kan ta upp eller frigöra fotoner för att resa andra energinivåer. Men när de blir tyngre kan de kristallisera och visa färger (som jodoform gör, chi3).
Polaritet
C-X-länkar skiljer sig från polaritet, men i omvänd ordning ovan:
C-F> C-CL> C-BR> C-I
Därför är C-F-länkar mer polära än C-I-länkar. När han är mer polär tenderar RF Halogenuros att interagera genom dipol-dipolo-styrkor. Under tiden, i RBR eller RI Halogenuros, är deras dipolmoment svagare och interaktioner som styrs av London -spridningskraften får större styrka.
Lösningsmedel
Eftersom alkylhalogenider är mer polära än alkaner från vilka de härrör, ökar de deras förmåga att lösa upp ett större antal organiska föreningar. Det är av denna anledning som de tenderar att vara bättre lösningsmedel; Även om det inte betyder att de kan ersätta alkanerna i alla applikationer.
Det finns tekniska, ekonomiska, ekologiska och prestandakriterier för att föredra ett halogenerat lösningsmedel framför en alkan.
Nomenklatur
Det finns två sätt att namnge en alkylhalogenid: med dess vanliga namn, eller med dess systematiska namn (IUPAC). Vanliga namn är vanligtvis bekvämare att använda när RX är enkelt:
Chcl3
Kloroform: Vanligt namn
Metyl eller triklormetan triklorid: IUPAC -namn.
Men de systematiska namnen är att föredra (och det enda alternativet), när de har grenade strukturer. Ironiskt nog är vanliga namn användbara igen när strukturer är för komplicerade (till exempel de som kommer att ses i det sista avsnittet).
Reglerna för att namnge en förening enligt IUPAC -systemet är desamma som för alkoholer: huvudkedjan identifieras, som är den längsta eller de mest grenade. Sedan listas kol som börjar i slutet närmast substituenter eller förgreningar, namngivning av alfabetisk ordning.
Exempel
För att illustrera det har du följande exempel:
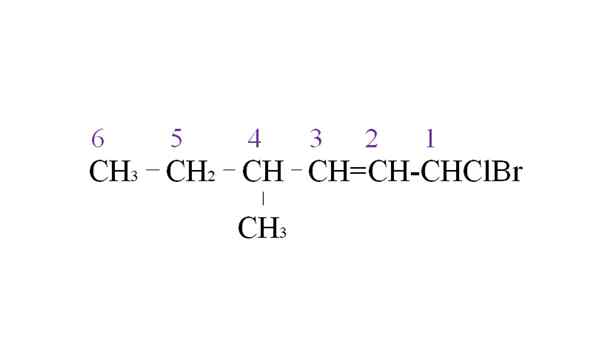 Hyra halogenid som ett exempel på nomenklatur. Källa: Gabriel Bolívar.
Hyra halogenid som ett exempel på nomenklatur. Källa: Gabriel Bolívar. Den första grenen är metylgruppen i C-4; Men med en dubbelbindning denna tidigare prioritet framför regeln som uttalats. Av den anledningen börjar den längsta kedjan listas från höger, ledd av en kolatom kopplad till två halogener: CL och BR.
Med uppräkningen namnges substituenterna i alfabetisk ordning:
1-Bromo-1-Clor-4-metyl-2-hexen.
Erhållande
För att erhålla alkylhalogenider måste molekyler överlämnas till en halogeneringsprocess; Det vill säga att införliva halogenatomer i deras strukturer, särskilt till en atom till en sp en kol3.
Det finns två metoder att erhålla eller syntetisera dem: genom ultraviolett strålning genom en fri radikal mekanism eller genom att lägga till hydracests eller halogener.
Halogenering med ljus eller ultraviolett strålning
Den första, minst lämpliga och med de värsta avkastningen, består i bestrålning av alkaner med ultraviolett strålning (Hv) I närvaro av en halogen. Till exempel visas ekvationerna för klorering av metan:
Ch4 + Kli2 => Ch3CL + HCL (under ultraviolett ljus)
Ch3Cl + cl2 => Ch2Kli2 + Hcl
Ch2Kli2 + Kli2 => CHCL3 + Hcl
Chcl3 + Kli2 => CCL4 + Hcl
De fyra föreningarna (ch3Cl, ch2Kli2, Chcl3 och CCL4) De bildas, och därför finns det en blandning, som kan underkastas fraktionerad destillation. Denna metod är emellertid inte särskilt praktisk, och den föredras att ta till organisk syntes.
Kan tjäna dig: fenylättiksyra: struktur, egenskaper, användningar, effekterEtt annat exempel är n-hexanbromering:
Ch3Ch2Ch2Ch2Ch2Ch3 + Bras2 => Ch3(BR) CHCH2Ch2Ch2Ch3 + Hbr
Återigen, i denna reaktion används ljuset eller ultraviolett strålning för att gynna bildandet av fria radikaler. Bromin, som är en intensiv röd vätska, missfärgas när den reagerar och därmed observerar en röd till färgglad färgförändring när 2-bromohexan.
Tillsats av hydracests eller halogener till alkener
Den andra metoden för att erhålla alkylhalogenuros är att behandla alkoholer (ROH) eller alkener (R2C = cr2) Med Hydrace. Hydracider har en HX allmän formel (HF, HCL, HBR och HI). Ett exempel kommer att visas med etanol för var och en av dem:
Ch3Ch2OH + HF => CH3Ch2F + h2ANTINGEN
Ch3Ch2OH + HCL => CH3Ch2Cl + H2ANTINGEN
Ch3Ch2OH + HBR => CH3Ch2Br + h2ANTINGEN
Ch3Ch2OH + HI => Cho3Ch2I + h2ANTINGEN
Alkenes kan också lägga till HX -molekyler till sina dubbelbindningar och bilda sekundära alkylhalogenuros.
Ch2= Ch-ch3 + Hbr => brch2-Ch2-Ch3 + Ch3-Chbr-ch3
Brch -produkten2-Ch2-Ch3 Det är 1-bromopropano och cho3-Chbr-ch3 2-bromopropan. Den andra är majoritetsprodukten eftersom den är den med den största stabiliteten, medan den förstnämnda produceras i mindre utsträckning eftersom den är mer instabil. Detta beror på att Cho3Chbrch3 Det är en sekundär alkylhalogenid.
Mycket liknande inträffar när det som läggs till alken är en X -molekyl2:
Ch2= Ch-ch3 + Bras2 => Brch2-Chbr-ch3
Emellertid erhålls en alkylhalogenid med två bromatomer kopplade till angränsande kolhydrater; grannskapshalogenid. Om de två bomos som var kopplade till samma kol togs å andra sidan, skulle det finnas en geminal alkylhalogenid, som följande:
Bras2Ch-ch2-Ch3
Reaktioner
Nukleofil substitution
Reaktiviteterna hos alkylhalogeniderna är i bräckligheten eller resistensen hos C-X-länken. Ju tyngre halogenen, desto svagare blir bindningen, och därför kommer den att brytas lättare. I en kemisk reaktion bryts länkar och nya bildas; C-X-länkar bryts för att bilda en C-G-länk (G = ny grupp).
I mer lämpliga termer fungerar X som en utgående grupp och G som en inkommande grupp i en reaktion av Nukleofil substitution. Varför inträffar denna reaktion? Eftersom x, att vara mer elektronegativ än kol, "stjäl" elektronisk densitet och lämnar ett elektronunderskott som översätter som en positiv partiell belastning:
CΔ+-XΔ-
Om en negativ art är runt närheten (: g-) eller neutral med ett par elektroner tillgängliga (: g), som kan bilda en mer stabil C-G-länk, kommer X att ersättas av G. Ovanstående kan representeras med följande kemiska ekvation:
Rx +: g- => Rg + x-
Ju svagare C-X- eller R-X-länken, desto större är dess reaktivitet eller tendens att ersättas av Nukleofil medel (eller nukleofil) g; det vill säga älskare av kärnor eller positiva laddningar.
Exempel
En serie allmänna ekvationer för nukleofila substitutioner som kan drabbas av alkylhalogenider visas nedan:
Rx + oh- => ROH + x- (Alkoholer)
+ Eller'- => Ror' (Etrar, syntes av Williamson)
+ Yo- => RI (Alkyl Yoduros)
+ Cn- => Rcn (nitrilos)
+ R'coo- => Rcoor '(estrar)
+ Nh3 => Rnh2 (Amines)
+ P (c6H5)3 => Rp (c6H5)3+ X- (Fosfoniumsalter)
+ Sh- => Rsh (tioles)
Kan tjäna dig: kemi -stadierFrån dessa exempel kan de värdefulla alkylhalogenider för organisk syntes misstänks. En av många ersättningar som saknades är Friedel Crafts reaktion, som används för att "hyra" aromatiska ringar:
Rx + arh + alcl3 => Rra
I denna reaktion ersätts en h av den aromatiska ringen av en grupp r -från rx.
Eliminering
Hyra halogenider kan frigöra HX -molekyler genom en eliminationsreaktion; Specifikt en dehydrohalogenering:
R2Ch-cxr2 + Åh- => R2C = cr2 + Hx
Det sägs att en dehydrohalogenering inträffar eftersom både en H och en X går förlorade i samma HX -molekyl.
Grignard -reagens syntes
Hyra halogenider kan reagera med vissa metaller som bildar Grignards reagens, som används för att lägga till R -grupper till andra molekyler. Den allmänna ekvationen för dess syntes är som följer:
Rx + mg => rmgx
Exempel
Under hela avsnitten har flera exempel på alkylhalogenuros redan nämnts. Några andra, enkla, är:
-Etylklorid, CH3Ch2Kli
-Isopropil fluoruro, (ch3)2Ch2F
-2-metyl-3-kloropentano, CH3-Ch (ch3) -Chcl -ch2Ch3
-Secbutilo yoduro, ch3Ch2Ch2I-ch3
-3-bromo-6-jodheptano, ch3-Ch2-Chbr-ch2-Ch2-Ch2Yo
-3.4-Dibromo-1-penteno, ch3-CHBR-chbr-ch = ch2
Ansökningar
Lösningsmedel
I tidigare sektioner gjordes omnämnandet av lösningsmedelskapaciteten för alkylhalogenider. Från den här egenskapen har branschen utnyttjat dem som städare, antingen för textilmaterial, elektroniska komponenter eller ta bort lackplatser.
De används också som lösningsmedel för målningar, eller organiska eller feta prover för otaliga typer av analytiska tester.
Organisk syntes
Hyra Halogenuros är mycket användbara för att "hyra" aromatiska ringar, medan de fungerar som en startkälla för syntes av praktiskt taget alla andra familjer av organiska föreningar. Syntetiskt betraktas Rx som en källa till grupper eller R -kedjor, som kan önskas att integrera mycket aromatiska föreningar.
Läkemedelsindustri
Det nämndes i början att halogenatomer interagerar med biologiska matriser, så i våra organismer kan de inte gå obemärkt utan att generera en förändring, positiv eller negativ. Om ett läkemedel utövar en positiv effekt på kroppen, kan ha en halogenatom som effekten kan öka eller inte öka.
Så om X är direkt kopplat ett kol med SP -hybridisering3, det kommer att finnas en alkylhalogenid och inte ett halogenerat derivat. Några av sådana halogenuros visas nedan i följande serie av bilder:
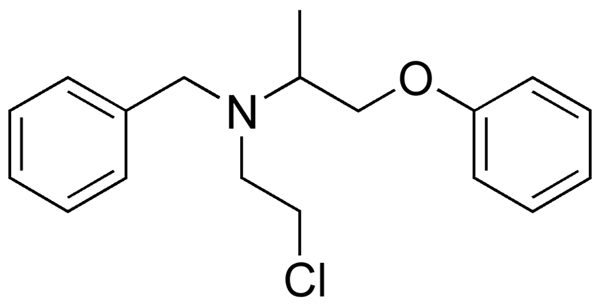 Fenoxibenzamin, en medicinering som används för att kombinera blodtryck hos patienter med feokromocytom. Källa: Utennt: Mark Pea [Public Domain].
Fenoxibenzamin, en medicinering som används för att kombinera blodtryck hos patienter med feokromocytom. Källa: Utennt: Mark Pea [Public Domain].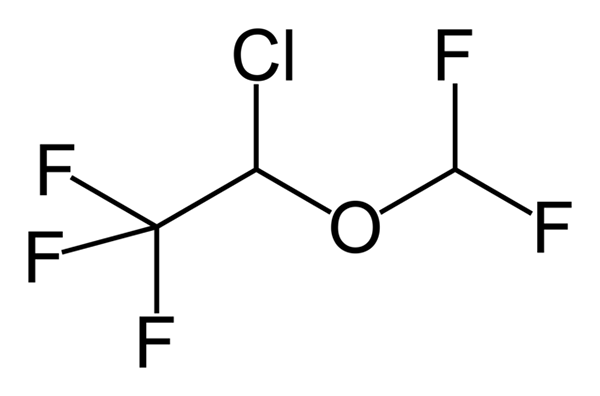 Isoflurano, en inandningsbedövning. Källa: Benjah-Bmm27 [Public Domain].
Isoflurano, en inandningsbedövning. Källa: Benjah-Bmm27 [Public Domain].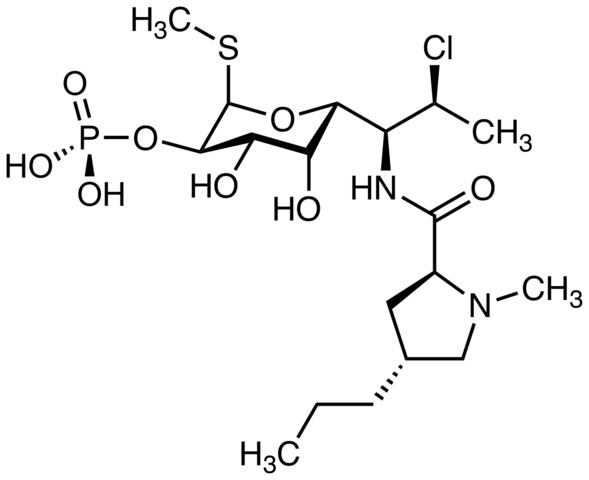 Clindamycin, ett antibiotikum. Källa: M Mitcheltrate [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)].
Clindamycin, ett antibiotikum. Källa: M Mitcheltrate [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)].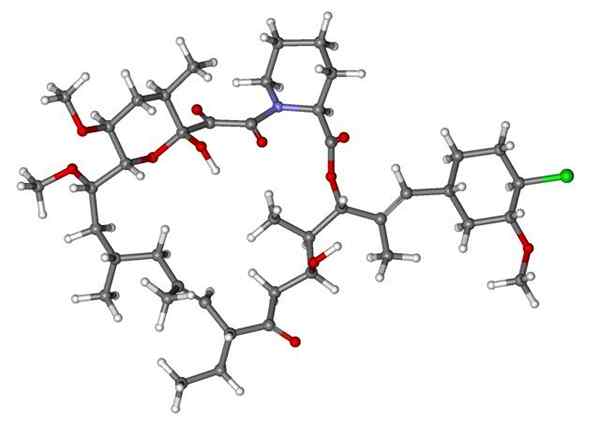 Pimecrolimus, används för att behandla atopisk dermatit. Kan du hitta kloratomen? Källa: Marinavladivok [CC0].
Pimecrolimus, används för att behandla atopisk dermatit. Kan du hitta kloratomen? Källa: Marinavladivok [CC0]. Halomon, möjlig antitumoral medel och alkylhalogenid av tångalgerna Portieria hornemannii, en naturlig källa. Källa: Jü [Public Domain]
Halomon, möjlig antitumoral medel och alkylhalogenid av tångalgerna Portieria hornemannii, en naturlig källa. Källa: Jü [Public Domain]
Observera att i dessa fem läkemedel finns det minst en länk av Cho -typen2-X eller ch-x; Det vill säga halogen är kopplad till ett sp -kol3.
Kylmedlemmar
Det berömda Freón-12 kylmedlet (CHCIF2), Som andra fluoroalcanos eller hydrofluorkolväten, ersatte de ammoniak och klorfluorkolväten (CFC) i denna funktion, eftersom de, till och med icke -flyktiga eller giftiga ämnen, förstörde ozonskiktet; Medan Freón-12, eftersom det är mer reaktivt, förstörs innan de når sådana höjder.
Referenser
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Clark Jim. (14 juli 2016). Användning av alkylhalider. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Gál, b., Bucher, c., & Burns, n. Z. (2016). Chiral alkylhalogenider: underexplorerade motiv i medicin. Marine Drugs, 14 (11), 206. Doi: 10.3390/MD14110206
- Alkylhalider. Hämtad från: Chemed.Kem.Purdu.Edu
- Patkar prachi. (16 juli 2017). Allt om alkylhalider: egenskaper, användningar och mycket mer. Naturvetenskap. Återhämtat sig från: sciencestruck.com
- R. fartyg. (2016). Alkylhalider. Återhämtat sig från: hyperfysik.Phy-astrage.Gsu.Edu
- Lärningsguide för kapitel 9 - Alkylhalider i. Återhämtat sig från: kaktus.Dixie.Edu
- Q.TILL. Eduardo Vega Barrios. (s.F.). Hyra Halogenuros: Egenskaper, användningsområden och applikationer. [PDF. Återhämtat sig från: cvonline.Uaeh.Edu.mx
- « Kvävesyra (HNO2) struktur, egenskaper, syntes
- Litiumbromidstruktur, egenskaper, användningar, risker »

