Kvävesyra (HNO2) struktur, egenskaper, syntes

- 4930
- 1356
- PhD. Lennart Johansson
han kvävesyra Det är en svag, oorganisk syra, vars kemiska formel är hno2. Det är i grunden i vattenlösning med en ljusblå färg. Det är väldigt instabilt, och det bryts snabbt in i salpetersoxid, nej och i salpetersyra, ino3.
Det är vanligtvis i vattenlösning i form av nitriter. Det kommer också naturligtvis från atmosfären till följd av reaktionen av kväveoxid med vatten. Där, särskilt i troposfären, ingriper kvävesyran i regleringen av ozonkoncentration.
 Kvävelösning i en bägare. Källa: Ingen maskinläsbar författare tillhandahållen. Den galna forskaren ~ Commonswiki antog (baserat på upphovsrättsanspråk). [Allmängods]
Kvävelösning i en bägare. Källa: Ingen maskinläsbar författare tillhandahållen. Den galna forskaren ~ Commonswiki antog (baserat på upphovsrättsanspråk). [Allmängods] I den övre bilden visas en HNO -lösning2 där den karakteristiska ljusblå färgen på denna syra kan ses. Det syntetiseras av upplösningen av kvävetrioxid, n2ANTINGEN3, I vatten. På samma sätt är det produkten från försurningen av natriumnitritlösningar vid låga temperaturer.
Hno2 Det har lite kommersiellt bruk, som använder i form av nitrit i bevarande av kött. Å andra sidan används det vid utarbetandet av azoiska färgämnen.
Det används tillsammans med natriumtiosulfat vid behandling av patienter med natriumcyanidförgiftning. Men det är ett mutagent medel, och det tros att det kan orsaka ersättningar i baserna i DNA -kedjorna, genom en oxidativ deaminering av cytosin och adenin.
Kvävesyra har ett dubbelt beteende, eftersom det kan bete sig som ett oxidativt medel eller som ett reducerande medel; det vill säga det kan reduceras till no eller n2, oxidera3.
[TOC]
Kvävsyrastruktur
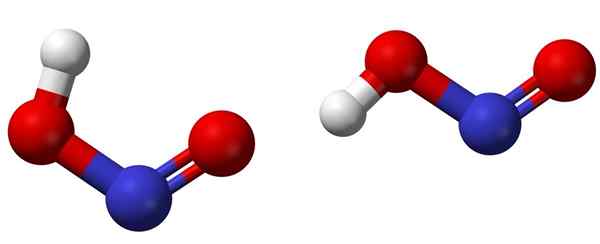 Cis (vänster) och trans (höger) isomerer med respektive molekylstrukturer av HNO2. Källa: Ben Mills [Public Domain].
Cis (vänster) och trans (höger) isomerer med respektive molekylstrukturer av HNO2. Källa: Ben Mills [Public Domain]. Den övre bilden visar den molekylära strukturen för kvävesyra med hjälp av en sfär- och staplarmodell. Kväveatomen (blå sfär) är belägen i mitten av strukturen och bildar en dubbelbindning (n = O) och en enkel (n-o) med syreatomer (röda sfärer).
Observera att väteatomen (vit sfär) är kopplad till en av syre och inte direkt till kväve. Så att veta detta, den strukturella formeln för HNO2 Det är [ho-n = o] eller [nej (OH)], och det finns ingen sådan H-N-länk (som den kemiska formeln kan tänka).
Bildmolekylerna motsvarar de i en gasfas; I vattnet är de omgiven av vattenmolekyler, som kan acceptera vätjonen (svagt) för att bilda jonerna inte2- och h3ANTINGEN+.
Kan tjäna dig: bägareDess strukturer kan anta två former: cis eller trans, kallad geometriska isomerer. I cis -isomeren försvinner H -atomen med den angränsande syreatomen; Medan de är i transisomeren finns båda i anti -oppositpositioner.
I cis-isomeren är bildningen av ett intramolekylärt väte (OH-NO) troligt, som kan importera intermolekylär (Onoh-onoh).
Egenskaper
Kemiska namn
-Kvävesyra
-Dioxonitric Acid (III)
-Nitrosilhydroxid
-Hydroxideoxidonitrogen (IUPAC Systematic Name)
Fysisk beskrivning
Blekblå vätska, motsvarande nitritlösningen.
Molekylvikt
47,013 g/mol.
Dissociationskonstant
Det är en svag syra. Dess PKA är 3,35 till 25 ºC.
Smältpunkt
Är endast känt i lösning. Därför kan din smältpunkt inte beräknas, och inte heller kan dina kristaller isoleras.
Kokpunkt
Genom att inte existera rent utan i vatten är mätningarna av denna egenskap inte exakta. Å ena sidan beror det på koncentrationen av HNO2, Och å andra sidan ger dess uppvärmning sin sönderdelning. Det är därför en exakt kokpunkt inte rapporteras.
Försäljningsbildning
Lösligt vatten -lösliga nitriter med LI+, Na+, K+, Växelström2+, herr2+, Ba2+. Men bildar inte salter med mångsidiga katjoner, till exempel: till3+ och/eller vara2+ (på grund av dess höga belastningstäthet). Det kan bilda stabila estrar med alkoholer.
Brandpotential
Det är brandfarligt för kemiska reaktioner. Kan explodera genom kontakt med fosfor triklorid.
Sönderfall
Det är en mycket instabil förening, och i vattenlösning sönderdelas den i salpetersyra och salpetersyra:
2 hno2 => Nej2 + Nej +h2ANTINGEN
4 hno2 => 2 hno3 + N2Eller +h2ANTINGEN
Reduktionsmedel
Kvävesyra i vattenhaltig lösning presenteras i form av nitritjoner, nr2-, som upplever flera reduktionsreaktioner.
Reagerar med joner i- och tro2+, I form av kaliumnitrit, för att bilda kväveoxid:
2 Kno2 + Ki +h2Sw4 => I2 + 2 nr +2 h2Eller +k2Sw2
Kaliumnitrit i närvaro av tennjoner reduceras för att bilda kväveoxid:
Kno2 + 6 HCl +2 SNCL2 => 2 SNCL4 + N2O +3 h2O +2 kcl
Kan tjäna dig: berylhydroxid (vara (OH) 2)Kaliumnitrit reduceras av Zn i en alkalisk miljö och bildar ammoniak:
5 h2O +kno2 + 3 Zn => NH3 + KOH +3 Zn (OH)2
Oxiderande medel
Förutom att vara ett reducerande medel kan kvävesyra ingripa i oxidationsprocesser. Till exempel: oxidera till vätesulfid, bli kväve eller ammoniakoxid, beroende på surhet hos mediet där reaktionen inträffar.
2 hno2 + H2S => s +2 nr +2 h2ANTINGEN
Hno2 + 3 h2S => S +NH3 + 2 h2ANTINGEN
Kvävesyra, i ett surt pH -medium, kan oxidera jodidjon till jod.
Hno2 + Yo- + 6 h+ => 3 i2 + Nh3 + 2 h2ANTINGEN
Du kan också fungera som ett reducerande agent som agerar på CU2+, orsakar salpetersyra.
Nomenklatur
Till HNO2 Du kan ge andra namn, som beror på typen av nomenklatur. Kvävesyran motsvarar den traditionella nomenklaturen; dioxonitric acid (III), till beståndsnomenklaturen; och dioxonitrat (iii) av väte, till det systematiska.
Syntes
Kvävesyra kan syntetiseras genom upplösning av kväve -trioxid i vatten:
N2ANTINGEN3 + H2O => 2 hno2
En annan metod för beredning är reaktionen från natriumnitriten, nano3, med mineralsyror; såsom saltsyra och bromhyterinsyra. Reaktionen görs vid låg temperatur och kvävesyran konsumeras in situ.
Äldre bror3 + H+ => Hno2 + Na+
H+ Det kommer antingen från HCl eller HBR.
Risker
Med tanke på dess kemiska egenskaper och egenskaper finns det lite information om de direkta toxiska effekterna av HNO2. Kanske orsakas vissa skadliga effekter som tros produceras av denna förening faktiskt av salpetersyra, som kan uppstå genom att sönderdela salpetersyra.
Det påpekas att hno2 Det kan ha skadliga effekter på luftvägarna och kunna ge symtom på irritation hos astmatiska patienter.
I form av natriumnitrit reduceras den av deoxyhemoglobin, vilket producerar kväveoxid. Detta är en kraftfull vasodilatator som producerar avslappning av de vaskulära glatta musklerna och uppskattar hos människor en LD50 -dos på 35 mg/kg för oral konsumtion.
Natriumnitritoxicitet manifesteras med en kardiovaskulär kollaps, följt av svår hypotension, på grund av vasodilatorverkan av kväveoxid, producerad från nitrit.
Kvävedioxid, nej2, Närvarande i förorenad luft (smog), under vissa förhållanden kan det orsaka kvävesyra; som i sin tur kan reagera med aminer för att bilda nitrosamin, en gamma av cancerframkallande föreningar.
Det kan tjäna dig: silveroxid (AG2O)En liknande reaktion uppstår med röken från cigaretter. Nitrosaminrester vidhäftade till det inre fodret för rökfordon har hittats.
Ansökningar
Diazoniumförsäljningsproduktion
Kvävesyra används i branschen vid produktion av diazoniumsalter, genom dess reaktion med aromatiska aminer och fenoler.
Hno2 + Rnah2 + H+ => Rna = nar +h2ANTINGEN
Diazoniumsalter används i organiska syntesreaktioner; Till exempel i Sandmeyers reaktion. I denna reaktion inträffar ersättningen av en aminogrupp (h2N-), i en primär aromatisk amin, av CL-grupperna-, Bras- och CN-. För att få dessa aromatiska produkter krävs kopparssalter.
Diazoniumsalter kan bilda lysande takföreningar som används som färgämnen och också fungerar som ett kvalitativt test för att upptäcka närvaron av aromatiska aminer.
Natrium azida eliminering
Kvävesyra används för att eliminera natriumazid3), vilket är potentiellt farligt för sin tendens att utnyttja.
2 nan3 + 2 hno2 => 3 n2 + 2 NO +2 NaOH
Syntes av oximor
Kvävesyra kan reagera med ketongrupper för att bilda oximas. Dessa kan oxideras för att bilda karboxiler eller reducerad syra för att orsaka amin.
Denna process används vid kommersiell beredning av adipinsyra, en monomer som används i nylonproduktion. Det ingriper också i produktionen av polyuretan och dess estrar är mjukgörare, främst i PVC.
Under sin saltlösning
Kvävesyra, i form av natriumnitrit, används vid behandling och bevarande av kött; Sedan förhindrar det bakterietillväxt och kan reagera med myoglobin, vilket ger en mörkröd färg som gör kött mer attraktivt för konsumtion.
Samma salt används tillsammans med natriumtiosulfat i den intravenösa behandlingen av natriumcyanidförgiftning.
Referenser
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. Aminer. (10th Utgåva.). Wiley Plus.
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Pub. (2019). Kvävesyra. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Softchools. (2019). Kvävesyra. Återhämtat sig från: softschools.com
- Wikipedia. (2019). Kvävesyra. Hämtad från: i.Wikipedia.org
- Royal Society of Chemistry. (2015). Kvävesyra. Återhämtat sig från: chemspider.com
- Ny världscyklopedi. (2015). Kvävesyra. Återhämtat sig från: Newworldyclopedia.org
- Drogbank. (2019). Kvävesyra. Återhämtat sig från: drugbank.Växelström
- Kemisk formulering. (2018). Hno2. Återhämtad från: Quimica -formulering.com
- « Siffror eller indikatorer som pratar om utbildningsframsteg i ett land
- Alkyl Halogenuros -egenskaper, erhållning, exempel »

