Kadmium (CD) historia, egenskaper, struktur, användningar

- 829
- 110
- Per Eriksson
han kadmium (CD) är en övergångs- eller post -överföringsmetall av atomnummer 48 och silverfärg. Det är formbart och duktil, med relativt låga smält- och kokpunkter. Kadmium är ett sällsynt element och har knappt en koncentration av 0,2 g / ton av jordskorpan.
La Greenockita (CDS) är den enda viktiga MENA för kadmium som presenterar en intensiv gul färg. Kadmiumet är associerat med zink i sphaleriten (ZnS), som innehåller mellan 0,1 och 03 % kadmium som en CD -katjon2+.
 Kadmiumkristaller. Källa: Hi-reser Bilder av kemiska element [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)]
Kadmiumkristaller. Källa: Hi-reser Bilder av kemiska element [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)] Vid bearbetning av sphanell för att erhålla, gjuteri och raffinering av zink erhålls kadmium sekundärt, detta är dess huvudsakliga produktionskälla.
Denna metall upptäcktes 1817, oberoende av Friedrich Stromayer och Karl Hermann. Stromayer döpt det nya elementet med namnet kadmium, härstammande från det latinska ordet "kadmia", en term som calamin (zinkkarbonat) var känd (zinkkarbonat).
 Kadmium är ett kemiskt element med CD -symbolen och dess atomnummer är 48. Källa: Albedo-UKR CC BY-SA 2.5 (http: // CreativeCommons.Org/licenser/BY-SA/2.5/)
Kadmium är ett kemiskt element med CD -symbolen och dess atomnummer är 48. Källa: Albedo-UKR CC BY-SA 2.5 (http: // CreativeCommons.Org/licenser/BY-SA/2.5/) Kadmium är ett element i stor nytta och många tillämpningar, såsom antikorrosivt järn, stål och icke -järnmetaller; Använd som pigment; PVC -stabilisering; element i legeringar som används i svetsar; Nickel-kadmiumbatterier laddas, etc.
Det är emellertid ett mycket giftigt element som orsakar allvarliga skador på lungorna, njurarna och benen, och till och med en cancerframkallande verkan har angetts, varför dess användning har varit begränsad. Men trots detta har det fortsatt att användas noggrant i vissa applikationer.
[TOC]
Historia
- Dubbelupptäckt
Kadmium upptäcktes av Friedrich Stromayer, en tysk kemist, 1817 i ett zinkkarbonatprov (Calamina). Samma år, K. S. L. Hermann och J. C. H. Roloff gjorde samma upptäckt, oberoende, i ett experiment som genomfördes med zinksulfid.
Det har påpekats att Stromayer gjorde sin upptäckt under uppfyllandet av en statlig ansökan för att inspektera apoteken i staden HildeSheim, Tyskland. Zinkoxid, som nu, användes vid behandling av vissa hudtillstånd.
Det verkar som om apotek inte utfärdade zinkoxid, utan istället sålde zinkkarbonat: råmaterial för zinkoxidproduktion. Zinkoxidtillverkare hävdade att zinkkarbonatet värms upp en gul "zinkoxid".
Kadmiumoxid
De kunde inte sälja denna "zinkoxid", eftersom färgen på föreningen normalt var vit; Och istället sålde de zinkkarbonat, också vita. Med tanke på denna situation beslutade Stromayer att studera den påstådda gula zinkoxiden.
För att göra detta värmde han prover av zinkkarbonat (kalamin) och det fanns en gul zinkoxid, som informerades. Efter att ha analyserat det drog han slutsatsen att den gula färgen var en produkt på grund av närvaron av en metallisk oxid av ett nytt element.
Efter att ha extraherat denna nya metalloxid producerade den sin reduktion och uppnådde kadmiumisolering. Stromayer bestämde sin densitet och erhöll ett värde av 8,75 g/cm3, Nära det värde som för närvarande är känt för denna parameter (8,65 g/cm3).
På samma sätt påpekade Stromayer att det nya elementet hade ett utseende som liknar platina, och att det också var närvarande i många zinkföreningar och inkluderande i den renade zink.
Stromayer föreslog namnet på "Cadmium" från den latinska rösten "Cadmia", namn som kallades Calamina, Znco3.
Kadmium i zinksulfid
Karl Hermann (1817) hittade en oändad gul färg när han bearbetade zinksulfid och trodde att det kunde vara en förorening med arsenik. Men när denna möjlighet kasserades insåg Hermann att han var i närvaro av ett nytt element.
- Ansökningar
1840-1940
På 1840 -talet började användningen av kadmium utnyttjas som pigment. Den brittiska farmaceutiska kodex indikerar 1907 användningen av kadmiumjodid som ett läkemedel för att behandla "utvidgade leder", skrovliga körtlar och sabañones.
På 1930- och 1940 -talet var kadmiumproduktionen avsedd för platina av stål och järn för att skydda dem från korrosion. På 1950 -talet användes kadmiumföreningar, såsom kadmiumsulfid och kadmiumselenid som röda, orange och gula pigmentkällor.
1970-1990
På 1970- och 1980 -talet upptäcktes att kadmiumkadmium- och stearatföreningarna var PVC -stabilisatorer, vilket gav en ökning av kadmiumbehovet. Men miljöföreskrifter på grund av toxiciteten hos kadmium.
På 1980- och 1990-talet stannade kadmiumet att använda många av dess tillämpningar, men sedan ökade dess produktion med skapandet av de laddningsbara batterierna i nickel-kadmium, som kom till att representera 80 % av konsumtionen av kadmium i USA.
Kan tjäna dig: Användningar och applikationer av AlceansFysiska och kemiska egenskaper hos kadmium
Utseende
Silled och mjuk grå -gris vit. Det blir sprött genom exponering för 80 ºC, att kunna klippa med en kniv. Är formbar och rullar kan bildas med honom.
Standardatomvikt
112,414 U
Atomantal (z)
48
Elementkategori
Post -övergångsmetall, växelvis betraktad som en övergångsmetall. Definitionen av IUPAC av en övergångsmetall är en vars atomer har en ofullständig underkapp eller som kan leda till katjoner med en ofullständig underkap.
Enligt den definitionen är kadmium inte en övergångsmetall sedan dess CD -katjon2+ Den har sina 4D -orbitaler helt fulla av elektroner (4D10).
Lukt
Toalett
Smältpunkt
321.07 ºC
Kokpunkt
767 ºC
Densitet
Omgivningstemperatur: 8,65 g/cm3
Vid smältpunkten (vätska): 7 996 g/cm3
Fusionsvärme
6.21 kJ/mol
Förångningsvärme
99,87 kJ/mol
Molorisk kapacitet
26,020 J/(mol · k)
Elektronnegativitet
1.6 På Pauling -skalan
Joniseringsenergier
Först: 867,8 kJ/mol (CD+ gasformig)
Andra: 1631,4 kJ/mol (CD2+ gasformig)
Tredje: 3616 kJ/mol (CD3+ gasformig)
Värmeledningsförmåga
96,6 W/(M · K)
Resistivitet Elektrisk
72,7 nΩ · m vid 22 ° C
Hårdhet
2.0 på Mohs -skalan. Det är en metall, även om den är tät, betydligt mjuk.
Stabilitet
Det oxideras långsamt med våt luft för att bilda kadmiumoxid, som plågar dess metalliska ljusstyrka. Det är inte brandfarligt, men i form av damm kan det brinna och uppleva självtjänst.
Självriktning
250 ºC för kadmium är en dammform.
Brytningsindex
1,8 till 20 ºC
Reaktivitet
Kadmium kan brinna i luften för att bilda kadmiumoxid (CAO), ett brunt amorft damm, medan den kristallina formen är mörkröd.
Kadmium reagerar snabbt med utspädd salpetersyra och långsamt med varm saltsyra. Han kan också reagera med svavelsyra, men reagerar inte med alkalis. I alla dessa reaktioner bildas kadmiumsalter av deras motsvarande anjoner (CL-) eller oxoanioner (nej3- Och så42-).
Elektronisk struktur och konfiguration
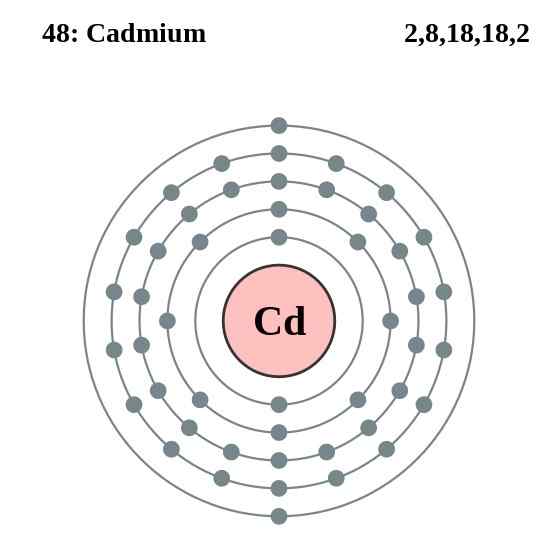 Kadmiumelektronskiktdiagram, element 48 i det periodiska tabellen. Källa: Pumbaa (originalverk av Greg Robson) CC BY-SA 2.0 (http: // Creativecommons.Org/licenser/BY-SA/2.0/)
Kadmiumelektronskiktdiagram, element 48 i det periodiska tabellen. Källa: Pumbaa (originalverk av Greg Robson) CC BY-SA 2.0 (http: // Creativecommons.Org/licenser/BY-SA/2.0/) Kadmiumatomerna i deras glas upprättar en metallbindning från deras valenselektroner, som är belägna i 4D- och 5S -orbitalerna enligt deras elektroniska konfiguration:
[KR] 4d10 5S2
Även om 4D -orbitalerna är fulla av elektroner, och att det också kan anses att ”elektronhavet” är rikligt med att starkt sammanföra CD -atomerna, i verkligheten är interaktionerna svaga. Detta kan demonstreras experimentellt med dess låga smältpunkt (321 ºC), jämfört med andra övergångsmetaller.
Därför och andra kemiska skäl betraktas kadmium ibland inte som en övergångsmetall. Det finns så många elektroner (tolv) involverade i deras metallbindning, som börjar störa deras negativa avvisningar; som tillsammans med energiskillnaden mellan 4D-orbitalerna och 5-talet försvagar CD-CD-interaktionen.
CD -atomer i slutändan definierar en kompakt hexagonal kristallin struktur (HCP), som inte lider av fasövergångar före dess smältpunkt. När kadmium HCP -kristaller genomgår ett tryck motsvarande 10 GPa, är strukturen endast deformerar; Men utan att rapportera någon fasändring.
Oxidationsnummer
Kadmium kan inte förlora de tolv elektronerna i Valencia; I själva verket kan du inte ens förlora en av dess 4D -orbitaler, mer stabil i energi jämfört med 5s orbital. Därför kan du bara förlora de två orbitalelektronerna 5s2, vara följaktligen en divalent metall; Som med zink-, kvicksilver- och alkaliska metaller (MR. Scholambara).
När förekomsten av CD -katjonen antas i dess föreningar2+, Det sägs då att kadmium har ett +2 oxidationsnummer eller tillstånd. Detta är dess huvudsakliga oxidationsnummer. Följande föreningar innehåller till exempel kadmium som +2: CDO (CD2+ANTINGEN2-), CDCL2 (CD2+Kli2-), CDSO4 (CD2+Sw42-) och CD (nej3)2.
Förutom detta oxidationsnummer finns det också +1 (CD+) och -2 (CD2-). Oxidationsnumret +1 observeras i CD -dikationen22+, där varje kadmiumatom har en positiv belastning. Samtidigt är -2 ganska konstig och skulle ansöka om anjonen "Cadmuro".
Var är det och få
 Greenockita kristaller. Källa: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Greenockita kristaller. Källa: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] Kadmium är ett sällsynt element som har en koncentration av 0,2 g / ton av jordskorpan. Det enda viktiga mineralet av kadmium är Greenockita (CDS), som inte är utnyttjande ur gruv- och kommersiell synvinkel.
Kan tjäna dig: flockning: reaktion, typer, applikationer, exempelKadmiumet är associerat med zink i Spheny Mineral (ZnS), som vanligtvis innehåller en koncentration som sträcker sig mellan 0,1 % och 0,3 %; Men i vissa fall kan koncentrationen av kadmium i sfaleriten nå 1,4 %.
Bearbetade bergarter för att erhålla fosforgödselmedel kan ha en kadmiumkoncentration av 300 mg / kg gödselmedel. Kol kan också innehålla små, men betydande mängder kadmium.
En viktig källa till kadmium är de vulkaniska utsläppen som kan föra kadmium till ytvatten. Användningen av fosforgödselmedel i jordbruksanvändningsjord har lett till kadmiumföroreningar.
Kadmium som finns i sura jordar är absorberbar av grönsaker. Några av grönsakerna används av människan som mat, vilket förklarar hur vatten- och matintag är den viktigaste källan till kadmiuminkomst hos personer som inte är professionellt exponerade eller rökning.
Sphaleritbehandling
Under gruvdrift, smältning och raffinering av den zink som finns i sphaleriten erhålls vanligtvis kadmium som en sekundär produkt. En liknande händelse inträffar också, men i mycket mindre utsträckning under koppar och blybearbetning.
På samma sätt kan små mängder kadmium erhållas från återvinning av järn och stålavfall.
Sprailen utsätts för rostat bröd så att zinksulfid blir dess oxid, zno. Samma reaktion lidit av kadmiumsulfid:
2 ZnS + 3 O2 → 2 Zno + 2 Så2
Om denna blandning av oxid värms upp med kol kommer de att reduceras till sina respektive metaller:
ZnO + CO → Zn + Co2
På samma sätt kan zink och kadmium produceras genom elektrolys vid upplösning av oxider i svavelsyra.
Endera av de två metoderna genererar en femtio förorenad med kadmium. Vid smältning kan kadmium destilleras i ett vakuum på grund av dess lägre smältpunkt (321 ° C) jämfört med den med CINC (420 ° C).
Isotoper
Bland de naturliga och stabila isotoperna av kadmium har vi, med deras respektive överflöd här på jorden:
-106CD (1,25%)
-108CD (0.89%)
-110CD (12,47%)
-111CD (12,8%)
-112CD (24,11%)
-114CD (28,75%)
-113CD (12,23%)
han 113CD är radioaktivt, men på grund av det stora värdet av dess halvliv (t1/2= 7,7 · 10femton år), kan betraktas som stabil. Och sedan finns det 116CD, även radioaktivt, med ett halvt liv på 3,1 · 1019 år, så det kan betraktas som en stabil isotop, som representerar 7,51 % av kadmium.
Observera att den genomsnittliga atommassan är 112 414 U, närmare 112 än 114. Förekomsten av en dominerande isotop ovanför de andra observeras inte i kadmium.
Risker
Allmän
Kadmiumabsorption sker främst av mat, särskilt lever, svamp, skaldjur, pulveriserad kakao och torr alger.
Ett emblematiskt fall inträffade i Kina under förra seklet, där det fanns en viktig förorening med kadmium i befolkningen. Kadmiumföroreningar berodde på dess höga koncentration i ris, orsakad av närvaron av kadmium i spannmålodlingar.
En rökare har ett genomsnittligt intag på 60 ug / dag. Den maximala koncentrationen av kadmium tillåtet i blodet är 15 ug / dag. Icke -rökare har en koncentration av kadmium i blodet runt 0,5 ug / L.
Lungorna absorberar mellan 40 och 60 % av kadmium som finns i tobaksrök. Kadmium som absorberas i lungorna transporteras i blodet och bildar komplex med proteiner, cystein och glutation, som sedan slutar i levern, njurarna, etc.
En akut inandning av kadmium kan orsaka symtom som liknar de som observerats i en influensaprocess; som förkylning, feber och muskelvärk, att kunna orsaka lungskador. Samtidigt kan kronisk exponering för kadmium orsaka lungsjukdom, njurar och ben.
Effekt på njurarna
I njurarna orsakar kadmium vanligtvis en förändring i fosfor och kalciummetabolism, vilket bevisas av en ökning av produktionen av njurberäkningar. Dessutom orsakar det njurskador som manifesteras i utseendet i urinen hos retinoltransportproteinet och p-2-mikroglobulinet.
Reproduktionseffekt
Mödrarnas exponering för kadmium är förknippad med en låg vikt av barnet vid födseln och en ökning av hastigheten för spontana aborter.
Benskada
Kadmium är relaterat i Japan till närvaron av Itai -Itai -sjukdom under förra seklet. Denna sjukdom kännetecknas av låg benmineralisering, benbräcklighet med hög sprickhastighet, ökad osteoporos och bensmärta.
Kan tjäna dig: CD3: egenskaper, funktionerCancerframkallande
Även om RATS -experiment etablerade ett samband mellan kadmium- och prostatacancer, har det inte visats hos människor. En koppling mellan kadmium och njurcancer har bevisats och har också kopplats till lungcancer.
Ansökningar
Nickel-kadmium laddningsbara bakterier
 Olika batterier eller Ni-CD-batterier. Källa: Boffy B via Wikipedia.
Olika batterier eller Ni-CD-batterier. Källa: Boffy B via Wikipedia. Kadmiumhydroxid användes som katod i Ni-CD-batterier. Dessa användes inom järnvägs- och flygindustrin, liksom i instrument för kollektivt bruk som inkluderar mobiltelefoner, videokamera, bärbara datorer etc.
Kadmiumförbrukning för utarbetande av NI-CD-batterier representerade 80 % av kadmiumproduktionen. På grund av toxiciteten för detta element har Ni-CD-batterier emellertid gradvis ersatts av nickel-metallhydridbatterier.
Pigment
 Kadmiumröd. Källa: Marco Almbauer [Public Domain]
Kadmiumröd. Källa: Marco Almbauer [Public Domain] Kadmiumsulfid används som gult pigment och kadmiumseleniuro som rött pigment, känd som kadmio rött. Dessa pigment kännetecknas av deras glans och intensitet, så de har använts i plast, keramik, glas, emaljer och konstnärliga färger.
Det har påpekats att målaren Vincent Van Gogh använde kadmiumpigment i sina målningar, vilket gjorde det möjligt för honom att uppnå en mängd rött, orange och ljusgul.
Färgen av kadmiumpigment måste dämpas innan de markeras med oljor eller blandas i akvareller och akryl.
Tv
Komponenter som innehåller kadmium användes i fosfor av svarta och vita tv -apparater, liksom i blå och gröna matcher för färg -tv -bildrör.
Fosfor var en del av skärmen som strålades av katodstrålar och var ansvarig för bildbildning. Kadmiumet, trots dess toxicitet, har börjat användas på QLED -tv -apparaterna för den senaste skapelsen.
PVC -stabilisering
Kadmiumföreningar bildade med karboxylat, laurerat och styrning användes som polyvinylkloridstabilisatorer, eftersom de försenar nedbrytningen som produceras genom exponering för värme och ultraviolett ljus som bryter ner PVC under dess tillverkningsprocess.
På grund av kadmiums toxicitet har PVC-stabilisatorerna förenats till kadmium ersatts av andra stabilisatorer, såsom barium, kalciumzink och organostaño.
Legeringar
Kadmium har använts för att bära legeringar på grund av dess höga motstånd mot trötthet och låg friktionskoefficient. Kadmium har en relativt låg smältpunkt, så den används i lågmältlegeringar och är komponent utöver många typer av svetsning.
Kadmium kan också användas i legeringar med elektrisk konduktivitet, värmeledningsförmåga och elektrisk kontakt.
Beläggning
Kadmium används för stålskydd, aluminium och andra icke -järnfästningselement, liksom mobila delar. Kadmiumbeläggningstillbehörskorrosionsskydd i dessa saltlösningar och alkaliska medier. Dessutom fungerar det som ett smörjmedel.
Kadmium används också i många elektriska och elektroniska applikationer som behöver korrosionsbeständighet och låg elektrisk resistivitet.
Kärnreaktorer
Kadmium används i kärnreaktorer för deras förmåga att fånga neutroner, vilket gör det möjligt att kontrollera överskott av neutroner av kärnklyvning och undvika ytterligare nukleära sprickor.
Halvledare
Seleniuro och kadmium telluriuro är föreningar som uppfyller funktionen av halvledare vid detektering av ljus och i solceller. HGCDTE är känslig för infrarött ljus och används som rörelsedetektor, liksom en switch för fjärrkontrollenheter.
biologi
 He-CD-laserljus. Källa: snarare anonym (https: // www.Flickr.com/foton/[e -post skyddar]/35766549)
He-CD-laserljus. Källa: snarare anonym (https: // www.Flickr.com/foton/[e -post skyddar]/35766549) Helium-CD ingriper i bildningen av en blåviolett laserstråle av en våglängd som sträcker sig mellan 325 och 422 nm, användbar i fluorescensmikroskop.
Kadmium används i molekylärbiologi för att blockera kalciumkanaler, beroende på membranpotentialen.
Referenser
- Wikipedia. (2019). Kadmium. Hämtad från: i.Wikipedia.org
- Djungel v. R. & et al. (2014). Högtryck och temperaturstruktur för vätska och solid CD: Implikationer för smältkurvan för CD. Återhämtat sig från: forskning.netto
- Doktor. Deg Stewart. (2019). Kadmiumelement fakta. Återhämtat sig från: Chemicool.com
- Nationellt centrum för bioteknikinformation. (2019). Kadmium. Pubchemdatabas. CID = 23973. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Gud, j., Scheidig, f., Grosse-siestup, c., Esche, v., Brandenburg, s., Reich, a., & Groneberg, D. TILL. (2006). Toxiciteten hos kadmium och resulterande faror för människors hälsa. Journal of Occupational Medicine and Toxicology (London, England), 1, 22. Doi: 10.1186/1745-6673-1-22
- ROS RACHEL. (30 juli 2018). Fakta om camium. Återhämtat sig från: Livescience.com
- Redaktörerna för Enyclopaedia Britannica. (6 september 2018). Kadmium. Encyclopædia Britannica. Återhämtat sig från: Britannica.com
- Internationell kadmiumförening. (s.F.). Kadmiumapplikationer. Återhämtat sig från: kadmium.org
- Lentech B. V. (2019). Kadmium. Återhämtat sig från: Lentech.com
- « Basala noder fungerar, anatomi och patologier
- Historikparasitologi, vad studerar du?, grenar, koncept »

