Förbränningsvärme

- 2135
- 184
- Anders Svensson
Vad är värmen av förbränning?
han Förbränningsvärme Det är energin som släpps när en viss mängd material, vanligtvis en mol, reagerar exotermiskt med luftens syre. Det är en väsentlig termokemiegenskap i karakteriseringen av bränslen, alkoholer och särskilt kolväten, såsom butan och metan.
När ett ämne brinner ljus och värme, energi som kan användas för att arbeta på andra kroppar. Till exempel kan värmen som genereras värma upp stora volymer vatten, vars ånga pressar omgivningen och agerar några elektriska generatorer; eller helt enkelt, ytterligare uppvärmning av ångade livsmedel.
 Värmen som genereras av förbränningen av köksgasen används för att värma kitteln och maten
Värmen som genereras av förbränningen av köksgasen används för att värma kitteln och maten Förbränningsvärme varierar mellan alla ämnen, även om dess kemiska natur i huvudsak är densamma. Denna variation motsvarar relativ stabilitet, det vill säga ju mer instabil en förening, desto större släpps energin, representerad som -ΔH. Den negativa symbolen innebär att värmen flyter ut.
Olika -Ch -värden används för att jämföra den relativa stabiliteten mellan olika alkaus och deras isomerer. Det tillåter också att det är stabilt.
Mått
För att mäta förbränningsvärme behövs en kalorimetrisk pump. Inom det reagerar ämnet med syre genom aktivering av en elektrisk gnista.
Sedan värmer värmen en volym vatten som omger provfacket, mäter temperaturen före och efter förbränning, liksom massan av vatten och bränsle.
Så den frigjorda energin kommer att vara lika med:
Ceh2o·mH2Eller · ΔT
Vareh2o Det är den specifika vattenvärmen, 4.184 J/G · ºC, mH2Eller massan av vattnet och ΔT dess temperaturförändring. Slutligen delas denna värme, uttryckt i joule- eller kalorienheter, mellan massan eller mullvadarna på bränslet som placeras i den kalorimetriska pumpen för att erhålla förbränningsvärmen per massa eller mullvader.
Kan tjäna dig: vad är den mekaniska motsvarigheten till värme?Metaller kombinerar inte sig, men oxiderar i olika hastigheter beroende på temperaturen vid vilken de utsätts. Värmen de producerar är föraktlig att mätas på samma sätt som det görs med kolväten och andra bränslen. De är därför inte brännbara ämnen.
Potentiella energier
Under förbränningen bryts länkarna för att bilda nya, mer stabila. Energin i alla en molekyllänkar är oberoende av dess rörelse, så det finns en potentiell energi.
Ju större den potentiella energin, desto mer instabil kommer molekylen att vara och därför kommer den att släppa mer värme när de nya länkarna är etablerade.
För att veta vilka exakt dessa nya länkar är, bör produkterna från en komplett förbränning övervägas: CO2 För kol, h2Eller för väte, och inte2 För kväve. När det gäller kolväten kommer deras fullständiga förbränning att generera stökiometriska blandningar av CO2 och h2ANTINGEN.
Båda molekylerna, CO2 och h2Eller de har mycket låga potentiella energier, eftersom deras länkar (O = C = O och H-O-H) är mycket stabila jämfört med kolvätelänkarna från vilka de kom (C-H och C-C).
Relativ stabilitet
Potentiella energier är fritt. Men deras variationer är inte, det vill säga skillnaden mellan dessa energier mellan produkterna (co2 och h2O) och reaktanter (kolväten).
Det är därför du har dessa variationer, eller vad som är samma, deras förbränning, du kan veta vad som är den relativa stabiliteten mellan en uppsättning kolväten eller isomerer.
Slutna
Alkanerna kan vara linjära, grenade eller cykliska. När det gäller linjära alkaner varierar dess förbränningsvärme beroende på längden på dess kedjor; det vill säga det beror på hur många enheter ch2 ha. Överväga exemplet med n-hexan, n-heptano och n-oktan:
Det kan tjäna dig: jod: historia, egenskaper, struktur, erhållning, risker, användningarCh3(Ch2)4Ch3, -ΔH = 4163 kJ/mol
Ch3(Ch2)5Ch3, -ΔH = 4817 kJ/mol
Ch3(Ch2)6Ch3, -ΔH = 5471 kJ/mol
Du kan se att förbränningsvärmen varierar med 654 kJ/mol. Detta betyder att varje cho2 som tillsätts till kedjan ökar förbränningsvärmen med en hastighet av 654 kJ/mol. Således nonano, ch3(Ch2)7Ch3, Den kommer att ha en förbränningsvärme lika med 6125 kJ/mol (5471 kJ/mol + 654 kJ/mol).
Detta är detsamma som att säga att längre kedjor har större potentiella energier, och därför är de mer instabila.
Förvirrade alkaner är mer stabila än linjära, och detta härleds från deras förbränningsvärm. Tänk nu på tre isomerer av oktanen:
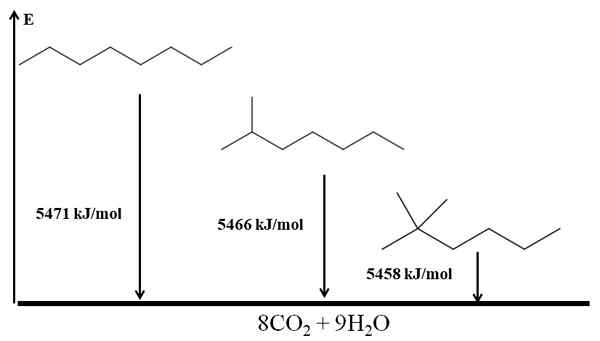 Förbränningsvärmar för tre oktanisomerer. Källa: Gabriel Bolívar via Molview.
Förbränningsvärmar för tre oktanisomerer. Källa: Gabriel Bolívar via Molview. han n-Octano är den mest instabila eftersom dess förbränningsvärme är den största (5471 kJ/mol). Å andra sidan, isomererna 2-metylheptano och 2,2-dimetylhexan. 2,2-dimetylhexan är den mest stabila för att vara den mest grenade av de tre isomererna.
Alkener
Alkenes relativa stabilitet kan också erhållas från deras förbränningsvärm. Tänk till exempel på fyra Butenus -isomerer:
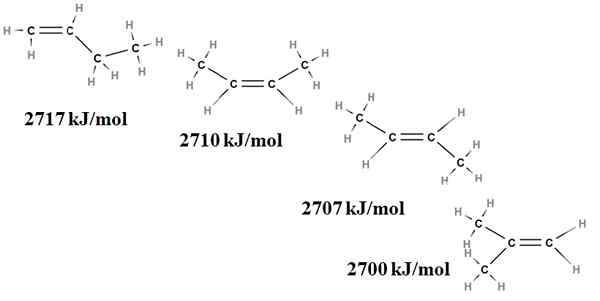 Förbränningsvärmar för Buteno -isomerer. Källa: Gabriel Bolívar via Molview.
Förbränningsvärmar för Buteno -isomerer. Källa: Gabriel Bolívar via Molview. Här pratar vi inte längre om förgreningar, utan om graden av ersättning av dubbelbindningen, C = C och dess van der Waals spänningar; Det vill säga av elektroniska och steriska avstötningar mellan två skrymmande grupper belägna på samma sida av dubbelbindningen.
Den första isomeren, 1-buten, är den mest instabila eftersom dess dubbelbindning är mindre ersatt (h2C = c). Detta återspeglas i dess förbränningsvärme på 2717 kJ/mol.
Kan tjäna dig: klorogensyraTill höger är CIS-2-butenen lite mer stabil eftersom dess dubbelbindning är mer ersatt. Men trans-2-butenen är ännu mer, för även om den har samma grad av substitution, grupperna3 av dubbelbindningen är i transpositioner, det vill säga på olika sidor av dubbelbindningen. Observera att värmen från trans-2-butenen (2707 kJ/mol) knappt är lite lägre än den för cis-2-buten (2710 kJ/mol).
Den sista isomeren, 2-metyl-2-butenen, som också ersätts lika som Cis och Trans 2 Bungeo, är ändå den mest instabila av alla. Detta beror på att båda ch3 De finns i en av kolbindningens kol och är därför en alken med Cho3 Geminaler.
Karbonylföreningar
Förutom alkos och andra kolväten i allmänhet är den relativa stabiliteten hos karbonylföreningarna (ketoner, aldehyder, karboxylsyror) också relaterade till deras förbränningsvärm.
Således, ju mer stabiliserade eller mindre reaktiva sina grupper c = o, minderåriga kommer att vara deras förbränningsvärm.
Till exempel värmen för förbränningen av butanal, ch3Ch2Ch2Cho, det är 2475 kJ/mol. Denna värme är högre än 2-butanon, Ch3Ch2Spetsa3, vilket är lika med 2442 kJ/mol. Därför är Butanal mer instabil än 2-butanon.
I 2-butanon är C = O mer stabiliserad tack vare grupperna CH3Ch2 och ch3; Sak som inte händer med butanen, där en av grupperna knappt är en atom h.
Referenser
- Morrison, r. T. och Boyd, R, N. (1987). Organisk kemi. Femte upplagan. Redaktör Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. (10: e upplagan.). Wiley Plus.
- Wikipedia. (2020). Förbränning. Hämtad från: i.Wikipedia.org
- CK-12 Foundation. Förbränning. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Bbc. (2020). Kemisk energi: entalpi av förbränning. Hämtad från: BBC.co.Storbritannien
- Steven a. Botekar. (2017). Illustrerad ordlista för organisk kemi: entalpi av förbränning. Återhämtad från: kem.Ucla.Edu

