Värmeformler och enheter, egenskaper, hur mäts, exempel

- 2527
- 652
- Per Eriksson
han värme I fysiken definieras det som Termisk energi överförd under förutsättning att objekt eller ämnen som är vid olika temperaturer läggs i kontakt. Denna energiöverföring och alla processer kopplade till den är föremål för studier av termodynamik, en viktig fysikgren.
Värme är en av de flera formerna som antar energi och en av de mest bekanta. Det är därför det är värt att fråga var det kommer ifrån. Svaret finns i atomerna och molekylerna som utgör saken. Dessa partiklar inuti saker är inte statiska. Vi kan föreställa oss dem som små konton förenade av mjuka fjädrar, kapabla att krympa och sträcka lätt.
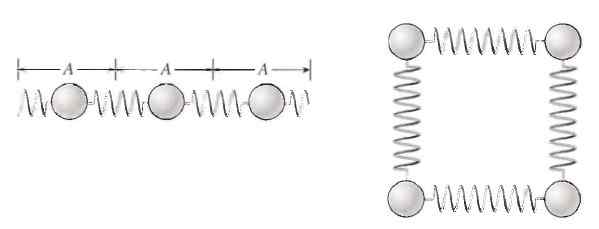 Atomer och molekyler vibrerar inuti ämnen, vilket innebär inre energi. Källa: P. Tippor. Fysik: koncept och applikationer.
Atomer och molekyler vibrerar inuti ämnen, vilket innebär inre energi. Källa: P. Tippor. Fysik: koncept och applikationer. På detta sätt kan partiklar vibrera och deras energi kan enkelt överföras till andra partiklar, och även från en kropp till en annan.
Mängden värme som en kropp absorberar eller ger, beror på ämnets natur, dess massa och temperaturskillnaden. Det beräknas så här:
Q = m.Coch .ΔT
Var Q Det är mängden överförd värme, m Det är objektets massa, Coch Det är den specifika värmen i ämnet och ΔT = Tslutlig - Tförsta, det vill säga temperaturskillnaden.
Som alla former av energi mäts värme i Joules, I det internationella systemet (SI). Andra lämpliga enheter är: ergioer I CGS -systemet, Btu I det brittiska systemet och kalori, En vanlig användningsterm för att känna till matens energiinnehåll.
[TOC]
Värmeegenskaper
 Effelvärmen är energi i överföringen. Källa: Pixabay
Effelvärmen är energi i överföringen. Källa: Pixabay Det finns flera viktiga koncept som måste beaktas:
-Värme handlar om Energi i transitering. Föremål har inte värme, de ger det bara till eller absorberar det enligt omständigheten. Vad objekt gör är inre energi, Under dess interna konfiguration.
Denna inre energi i sin tur består av kinetisk energi förknippad med vibrationsrörelse och potentiell energi, typisk för molekylkonfiguration. Enligt denna konfiguration kommer ett ämne att överföra värme mer eller lättare och detta återspeglas i dess specifika värme Coch, Värdet som nämns i ekvationen för att beräkna q.
-Det andra viktiga konceptet är att värme alltid överförs från den hetaste kroppen till den kallaste. Erfarenheten indikerar att värmen med varmt kaffe alltid passerar mot porslinet i koppen och plattan, eller till metallen i skeden som den är rör.
-Mängden värme som tilldelats eller absorberas beror på massan av kroppen i fråga. Lägg till samma mängd kalorier eller joules till ett prov med x -degen värmer inte upp till en annan vars massa är 2x.
Kan tjäna dig: elektromagnetiska vågor: Maxwell teori, typer, egenskaperAnledningen? Det finns fler partiklar i det största provet, och var och en skulle få i genomsnitt bara hälften av energin än det minsta provet.
Termisk balans och energibesparing
Erfarenheten säger att när vi sätter två objekt i olika temperatur kommer temperaturen för båda att vara samma tid. Då kan det bekräftas att objekt eller system, som de också kan kallas, är i termisk jämvikt.
Å andra sidan, reflektera över hur man kan öka den inre energin i ett isolerat system, dras slutsatsen att det finns två möjliga mekanismer:
i) Värm det, det vill säga överför energi från ett annat system.
i) Gör någon typ av mekaniskt arbete på honom.
Med hänsyn till att energi bevaras:
Varje ökning av systemets inre energi är lika med mängden värme som tillsätts mer det arbete som görs på det.
Inom ramen för termodynamik är denna bevarandeprincip känd Första lagen om termodynamik. Vi säger att systemet måste isoleras, annars bör andra inträdes- eller energiutgångar övervägas i balansen.
Hur mäts värmen?
Värme mäts enligt effekten den ger. Därför är det känslan av beröring som snabbt informerar hur varmt eller kallt är en drink, en måltid eller något föremål. Sedan han ger eller absorberar värme översätter till temperaturförändringar, har mätning av denna en uppfattning om hur mycket värme den har överförts.
Instrumentet som används för att mäta temperaturen är termometern, en enhet försedd med en graderad skala för att utföra avläsningen. Det mest kända är kvicksilvertermometern, som består av en fin kvicksilverkapillär som expanderar vid uppvärmning.
 En termometer med examen i Celsius och Fahrenheit skalor. Källa: Pixabay.
En termometer med examen i Celsius och Fahrenheit skalor. Källa: Pixabay. Sedan sätts kapillären full av kvicksilver i ett glasrör med en skala och sätter i kontakt med kroppen vars temperatur ska mätas tills de når den termiska jämvikten och temperaturen på båda är densamma.
Vad som krävs för att göra en termometer?
Till att börja med är det nödvändigt att ha en viss termometrisk egendom, det vill säga en som varierar med temperaturen.
Till exempel en gas eller en vätska som kvicksilver, expandera vid uppvärmning, även om den också serverar elektrisk motstånd, som avger värme när den korsas av en ström. Kort sagt kan alla termometriska egenskaper som lätt kan användas användas.
Om temperaturen t är direkt proportionell mot termometrisk egendom X, Då kan du skriva:
t = kx
Var k Det är konstanten av proportionalitet som ska bestämmas när två lämpliga temperaturer ställs in och motsvarande värden på X. Lämpliga temperaturer betyder lätt att få i laboratoriet.
Kan tjäna dig: Oblique Parabolic Shot: Egenskaper, formler, ekvationer, exempelNär par har upprättats (t1, X1) och ((t2, X2), Intervallet mellan dem är uppdelat i lika delar, dessa kommer att vara betyg.
Temperaturskalor
Valet av nödvändiga temperaturer för att bygga en temperaturskala görs med kriteriet som de är lätta att få i laboratoriet. En av de mest använda skalorna över hela världen är Celsius-skalan, skapad av den svenska forskaren Anders Celsius (1701-1744).
0 i Celsius -skalan är temperaturen vid vilken is och flytande vatten är i jämvikt vid 1 tryckatmosfär, medan det övre stoppet väljs när flytande vatten och vattenånga är lika i jämvikt och vid en atmosfär av tryck. Detta intervall är uppdelat i 100 grader, som var och en kallas centigrade.
Detta är inte det enda sättet att bygga en skala, mycket mindre. Det finns andra olika skalor, till exempel Fahrenheit -skalan, i vilken intervall har valts med andra värden. Och det finns Kelvin -skalan, som bara har ett lägre stopp: det absoluta nollet.
Den absoluta noll motsvarar temperaturen i vilken varje rörelse av partiklar i ett ämne upphör helt, även om det har varit ganska nära har inget ämne ännu inte kylts till den absoluta noll.
Exempel
All upplever värme dagligen, antingen direkt eller indirekt. Till exempel när en varm drink tas, när man tar emot middagssolen, undersöker bilens motortemperatur, i ett rum fullt av människor och i otaliga fler situationer.

På jorden är värme nödvändig för att upprätthålla livets processer, både den som kommer från solen och den som lämnar planetens inre.
På samma sätt drivs klimatet av förändringar i termisk energi som förekommer i atmosfären. Solens värme når inte lika med överallt, ekvatoriala breddegrader anländer mer än polerna, så den hetaste luften i tropikerna stiger och rör sig norr och söder för att uppnå termisk jämvikt som diskuterades tidigare.

På detta sätt etableras luftströmmar i olika hastigheter, som transporterar moln och regn. Å andra sidan orsakar den plötsliga kollisionen mellan heta och kalla fronter fenomen som stormar, tornadon och orkaner.
Å andra sidan, på en närmare nivå, kanske värme inte är lika välkommen som en solnedgång på stranden. Värme orsakar driftsproblem i bilmotorer och datorprocessorer.
Kan tjäna dig: watt lag: vad är, exempel, applikationerDet får också el att gå förlorad när man kör kablar och material dilat, så värmebehandling är så viktigt inom alla teknikområden.
Övningar
- Övning 1
På etiketten på en godis läser som bidrar med 275 kalorier. Hur mycket energi i Joules motsvarar denna godis?
Lösning
I början hade kalorin nämnts som en enhet för värme. Livsmedel innehåller energi som vanligtvis mäts i dessa enheter, men att äta kalorier är faktiskt kilokalorier.
Ekvivalensen är som följer: 1 kcal = 4186 j, och det dras slutsatsen att behandlingen har:
275 kilokalorier x 4186 Joule/kilocaloria = 1.15 106 J.
- Övning 2
100 g upphettas till en metall upp till 100 ° C och placeras i en kalorimeter med 300 g vatten vid 20 ° C. Temperaturen som förvärvats av systemet när det når balans är 21.44 ° C. Det uppmanas att bestämma metallens specifika värme, förutsatt att kalorimetern inte absorberar värme.
Lösning
I denna situation ger metallen värme, som vi kommer att kalla QSken Och ett tecken (-) läggs innan du indikerar förlust:
QSken = mmetall .Ecmetall. ΔT
För sin del absorberar kalorimetern värmen, som kommer att betecknas som absorberad:
Qabsorberad = mvatten .Ec vatten . ΔT
Energin bevaras, från vilken den följer det:
QSken = Qabsorberad
Från uttalandet kan du beräkna ΔT:
Metall: ΔT = Tslutlig - Tförsta= (21.44 - 100) ºC = -78.56 ºC = -78.56 K.
Vatten: Δt = tslutlig - Tförsta= (21.44 - 20) ºC = 1.44 ºC = 1.44 K.
Viktig: 1 ºC är samma storlek som 1 kelvin. Skillnaden mellan båda skalorna är att Kelvin -skalan är absolut (Kelvin -betyg är alltid positiva).
Den specifika vattenvärmen vid 20 ºC är 4186 J/kg. K och med detta kan du redan beräkna den absorberade värmen:
Qabsorberad = mvatten .Ec vatten . ΔT = 300 x 10-3 kg . 4186 j/kg . K . 1.44 K = 1808.35 J.
Avslutningsvis rensas den specifika metallvärmen:
Ec metall = Q absorberad /-M metall . ΔT metall = 1808.35 J / -[(100 x 10-3 kg. (-78.56 K)] = 230.2 j/kg.K
Referenser
- Bauer, w. 2011. Fysik för teknik och vetenskap. Volym 1. McGraw Hill.
- Cuellar, J.TILL. Fisca II: Kompetensstrategi. McGraw Hill.
- Kirkpatrick, l. 2007. Fysik: En titt på världen. 6ta Förkortad upplaga. Cengage Learning.
- Riddare, r. 2017. Fysik för forskare och teknik: En strategistrategi. Pearson.
- Tippens, s. 2011. Fysik: koncept och applikationer. Sjunde upplagan. McGraw Hill
- « Tidigare färger Egenskaper och mening
- Natriummetabisulfite (Na2S2O5) struktur, egenskaper, användningar, risker »

