Aluminiumkarbonatstruktur, egenskaper, användningar
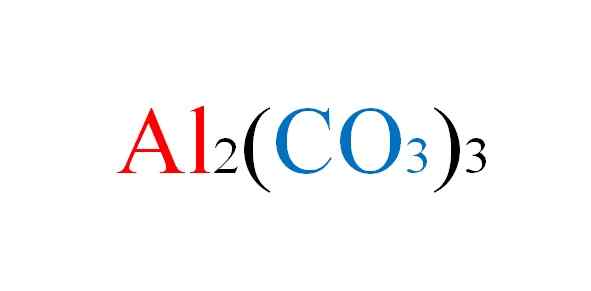
- 4877
- 1066
- Johan Olsson
han Aluminiumkarbonat Det är ett oorganiskt salt vars kemiska formel är2(Co3)3. Det är en praktiskt taget icke -existerande metallkarbonat, med tanke på dess höga instabilitet under normala förhållanden.
Bland orsakerna till dess instabilitet kan vi nämna de svaga elektrostatiska interaktionerna mellan jonerna till3+ och co32-, som i teorin bör vara mycket stark för storleken på deras belastningar.
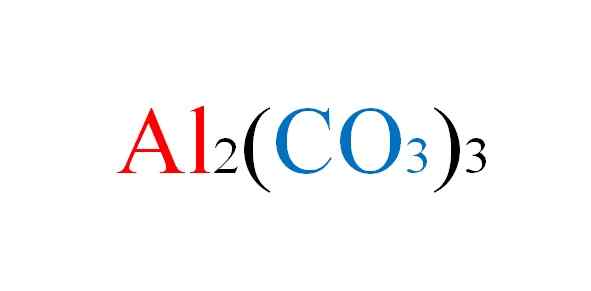 Aluminiumkarbonatformel. Källa: Gabriel Bolívar.
Aluminiumkarbonatformel. Källa: Gabriel Bolívar. Salt står inför eventuella besvär i papper när de kemiska ekvationerna för deras reaktioner skrivs; Men i praktiken är det emot det.
Trots vad som sades kan aluminiumkarbonat förekomma i sällskap med andra joner, som är fallet med Dawsonite Mineral. Det finns också ett derivat där det interagerar med den vattenhaltiga ammoniak. Av resten betraktas det som en blandning mellan Al (OH)3 och h2Co3; vilket är lika med en brusande lösning med en vit fällning.
Denna blandning har medicinsk användning. Men till det rena, isolerbara och manipulerbara saltet av Al2(Co3)3, Du är inte känd möjliga applikationer; Åtminstone inte låga enorma tryck eller extrema förhållanden.
[TOC]
Aluminiumkarbonatstruktur
Den kristallina strukturen för detta salt är okänd, eftersom det är så instabilt att det inte har kunnat karakteriseras. Från sin formel till2(Co3)3, Det är emellertid känt att andelen joner till3+ och co32- Det är 2: 3; det vill säga att för varje två katjoner till2+ Det måste finnas tre anjoner co32- interagerar elektrostatiskt med dem.
Problemet är att båda jonerna är mycket ojämlika när det gäller deras storlekar; AL3+ Det är väldigt litet medan CO32- Det är skrymmande. Denna skillnad påverkar i sig redan den retikulära stabiliteten i det kristallina nätverket, vars joner skulle interagera "besvärligt" om detta salt i fast tillstånd är isolerat.
Det kan tjäna dig: Avogadro Number: Historia, enheter, hur det beräknas, använder användningarFörutom denna aspekt, Al3+ Det är en mycket polariserande katjon, egenskap som deformerar CO: s elektroniska moln32-. Det är som om han ville tvinga honom att länka kovalent, även om anjonen inte kan göra det.
Följaktligen joniska interaktioner mellan Al3+ och co32- De tenderar mot kovalens; En annan faktor som bidrar till instabiliteten hos Al2(Co3)3.
Hydroxidkarbonat aluminium ammonium
Det kaotiska förhållandet mellan Al3+ och co32- Det mjuknar i utseende när det finns andra joner närvarande i glaset; som NH4+ och åh-, från en ammoniaklösning. Denna jonkvartett, till3+, Co32-, Nh4+ och åh-, De lyckas definiera stabila kristaller, till och med kapabla att använda olika morfologier.
Ett annat exempel som liknar detta observeras i det dawsonite mineralet och dess ortorrombiska kristaller, Naalco3(ÅH)2, Där na+ ersätt NH4+. I dessa salter är deras joniska bindningar tillräckligt starka så att vatten inte främjar frigörandet av CO2; eller åtminstone inte plötsligt.
Även om NH4Al (OH)2Co3 (AACC, för sina siglar på engelska), inte heller Naalco3(ÅH)2 De representerar aluminiumkarbonat, de kan betraktas som grundläggande derivat av samma.
Egenskaper
Molmassa
233,98 g/mol.
Instabilitet
I föregående avsnitt förklarades det ur ett molekylärt perspektiv varför al2(Co3)3 Det är instabilt. Men vilken omvandling lider den? Du måste överväga två situationer: en torr och den andra "våt".
Torr
I den torra situationen, anjonen CO32- Co är omvänd2 Genom följande nedbrytning:
Till2(Co3)3 => Al2ANTINGEN3 + 3co2
Det kan tjäna dig: kalciumfosfat (CA3 (PO4) 2)Vilket är meningsfullt om det syntetiseras under aluminiumoxid till stora tryck på CO2; det vill säga den omvända reaktionen:
Till2ANTINGEN3 + 3co2 => Al2(Co3)3
Därför för att undvika att sönderdela AL2(Co3)3 Du måste skicka salt till Great Pressure (med N2, Till exempel). På detta sätt bildningen av CO2 skulle inte bli termodynamiskt gynnad.
Våt
Medan i den våta situationen, CO32- Det lider hydrolys, som genererar små mängder OH-; Men tillräckligt för att aluminiumhydroxid ska fälla ut, vid (OH)3:
Co32- + H2Eller hco3- + Åh-
Till3+ + 3OH- Al (OH)3
Och å andra sidan Al3+ Det är också hydrolyserat:
Till3+ + H2Eller till (oh)22+ + H+
Även om det verkligen skulle vara hydratiserat3+ Att bilda komplexet till (h2ANTINGEN)63+, som är hydrolyserad för att ge [till (h2ANTINGEN)5Åh]2+ och h3ANTINGEN+. Sedan h3Eller (eller h+) Protona till co32- till H2Co3, som bryter ner till co2 och h2ANTINGEN:
Co32- + 2h+ => H2Co3
H2Co3 Co2 + H2ANTINGEN
Observera att i slutändan AL3+ Det beter sig som en syra (frisläppande h+) och en bas (släpp OH- Med balansen mellan löslighet hos Al (OH)3); det vill säga det visar amfoterism.
Fysisk
För att kunna isolera sig är detta salt troligtvis vitt, som många andra aluminiumsalter. På grund av skillnaden mellan de joniska radioerna från Al3+ och co32-, Visst skulle det ha mycket låga smält- eller kokpunkter jämfört med andra joniska föreningar.
Det kan tjäna dig: Benchilo: Benzylhydrogener, Carbocations, Benzyl RadicalsOch när det gäller dess löslighet skulle det vara oändligt lösligt i vatten. Dessutom skulle det vara ett hygroskopiskt och läckert fast ämne. Detta är dock bara antaganden. Andra egenskaper måste uppskattas med beräkningsmodeller som är föremål för höga tryck.
Ansökningar
De applikationer som är kända från aluminiumkarbonat är medicinska. Det användes som ett mjukt sammandragande och som ett läkemedel för att behandla inflammation och magsår. Det har också använts för att förhindra bildning av urinberäkningar hos människor.
Det har använts för att kontrollera en ökning av kroppsinnehållet i fosfat och även för att behandla magsyra -symtom, syra matsmältningsbesvär och magsår.
Referenser
- Xuehui l., Zhe t., Yongming c., Ruiyu z. & Chenguang L. (2012). Hydrotermisk syntes av ammoniumaluminiumkarbonathydroxid (AACH) nanoplatelets och nanofibrer pH-kontrollerade morfologier. Atlantis Press.
- Robin Lafficher, Mathieu Digne, Fabien Salvatori, Malika Boualleg, Didier Colson, Francois Puel (2017) Ammonium aluminiumkarbonathydroxid NH4AL (OH) 2CO3 som en alternativ väg för aluminiumberedning: Jämförelse med den klassiska boehmitiska prekurser. Powder Technology, 320, 565-573, doi: 10.1016/j.Powec.2017.07.0080
- Nationellt centrum för bioteknikinformation. (2019). Aluminiumkarbonat. Pubchemdatabas., CID = 1035396. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Wikipedia. (2019). Aluminiumkarbonat. Hämtad från: i.Wikipedia.org
- Aluminumsulfat. (2019). Aluminiumkarbonat. Återhämtad från: aluminumsulfate.netto

