Kalciumkarbonatstruktur, egenskaper, bildning, användningar

- 1485
- 23
- Johan Gustafsson
han kalciumkarbonat Det är en oorganisk förening vars kemiska formel är Caco3. Det finns främst i mineraler som kalcit och aragonit. På samma sätt komponerar kalkstenen, en sedimentär sten där kalcita -mineralet är närvarande.
Detta viktiga metallkarbonat erhålls industriellt genom extraktion och slipning av mineralerna som innehåller det; För detta ändamål används marmor främst. En annan process ligger i användningen av kalciumoxid, som blir kalciumhydroxid, utfällning av kalciumkarbonat genom tillsats av koldioxid. På detta sätt erhålls kristaller från ett brett utbud av storlekar.
 Snigelskalet består främst av kalciumkarbonat. Källa: Pixabay.
Snigelskalet består främst av kalciumkarbonat. Källa: Pixabay. De kan också användas för Caco Industrial Production3, I liten skala, skalen på musslorna, äggskalorna och ostronskalarna där det är närvarande.
Kalciumkarbonat närvarande i kalksten löses genom koldioxid i vatten, vilket genererar kalciumbikarbonat. Denna åtgärd kan orsaka grottorna och är en orsak till alkalinering av vatten; händelse av stor betydelse för att upprätthålla livet i det.
Det har använts vid konstruktion och utarbetande av skulpturer; Exempel på detta är partner till Aten, katedralen i Krakow och skulpturen av Abraham Lincoln i Washington. Emellertid har dess mottaglighet för surt regn minskat användningen i konstruktionen.
Kalciumkarbonat har haft flera applikationer i branschen som ett plast- och pappersfyllningsmaterial. I medicin har det använts för att kontrollera gastrisk surhet; som dietkalciumtillskott; att kontrollera fosfati hos patienter med kronisk njursvikt etc.
[TOC]
Strukturera
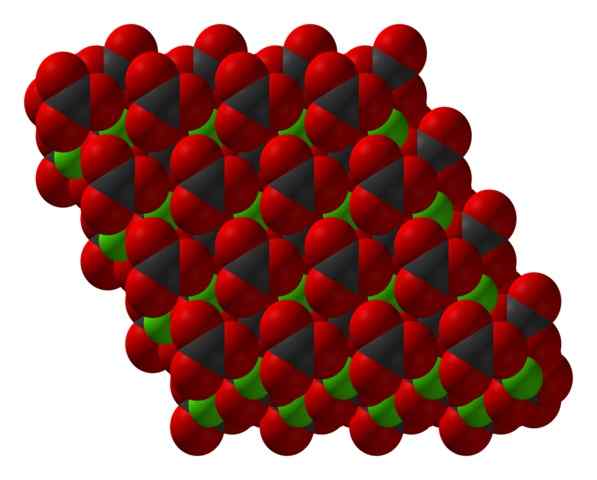 Chanco3 Kristallin struktur representerad med en rymdfyllningsmodell. Källa: CCOIL [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Chanco3 Kristallin struktur representerad med en rymdfyllningsmodell. Källa: CCOIL [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] Kalciumkarbonatformeln, Caco3, indikerar att andelen mellan Ca -joner2+ och co32- Det är 1: 1; det vill säga för varje CA2+ Det finns en co32- av motsvarigheten som interagerar elektrostátiskt med honom. Således slutar den joniska bindningen med dessa joner för att bilda strukturella mönster som definierar en kristall.
I den överlägsna bilden visas strukturen på Caco3. Gröna sfärer motsvarar CA -katjoner2+, och de röda och svarta sfärerna till co -anjonerna32-. Observera att strukturen verkar bildas av flera lager: ett av kalcium och en annan karbonat; vilket innebär att kristalliseras i en kompakt hexagonal struktur.
Det kan tjäna dig: ammoniumklorid (NH4CL)Denna hexagonala fas (ß-kako3) Motsvarar en polymorf. Det finns två andra: ortorrombic (λ-caco3) och en ännu tätaste hexagonal (μ-caco3). Den lägre bilden hjälper till att bättre visualisera den lyckliga hexagon:
 Kalcitstruktur. MaterialScientist på English Wikipedia [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Kalcitstruktur. MaterialScientist på English Wikipedia [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] Beroende på temperaturen (och för detta salt justeras emellertid jonerna i deras vibrationer till andra strukturer; Dessa är de ovannämnda polymorferna (β, λ och μ).
Eftersom de låter inte är välkända, såvida de inte nämns med sina mineralogiska namn i ett nästa avsnitt.
Proteinhårdhet
Caco's Crystals3 De är inte ensamma: de kan vara värd för föroreningar som andra metallkatjoner som färgar dem i färger; o Proteiner, som innehåller en organisk matris som på något sätt bidrar till dess naturliga hårdhet.
Proteiner minskar spänningen som kristaller upplever från varandra före ett tryck eller en påverkan. Som? När man är blandad mellan kristallerna, fungerar som om det var en "dyna" (liknande tegel-cement-lady).
Det är därför denna förening eller mineral är biokompatibel, och det är inte förvånat att det är en del av naglarna, marina skal, skal eller ben på igelkottarna. Det har varit en inspirationskälla för dem som är dedikerade till att utveckla nya material.
Egenskaper
Andra namn
-Aragonit
-Kalcito
-Volterit
-Kalcialmjölk
-Whiteboard
-Marmor
Molmassa
100,086 g/mol.
Fysisk beskrivning
Vit dammtoalett.
Smak
Liknar krita, smaklös.
Fusions- och kokpunkter
Det bryts ned eftersom det släpper co2 Innan ens smältning eller kokning.
Löslighet
Praktiskt taget olöslig i vatten och alkohol. Det är upplöst med brus i utspädda ättiksyror och saltsyror. Hydroxider minskar emellertid sin löslighet. Samtidigt ökar ammoniumsalter och koldioxid lösligheten för kalciumkarbonat i vatten.
Densitet
2,7 till 2,95 g/cm3.
Sönderfall
Cirka 825 ºC bryts ned i kalciumoxid (kalk) och koldioxid (CO2).
pH
8 till 9
Brytningsindex
-1 7216 till 300 nm och 1 6584 till 589 nm (calcita).
-1 5145 till 300 nm och 1 4864 till 589 nm (aragonite).
Oförenlighet
Med syror, aluminium och ammoniumsalter.
Fusionsentalpi
36 kJ/mol vid 800 ºC (Calcite).
Kan tjäna dig: molaritet: koncentration, enheter, beräkning, övningarLöslighetsproduktkonstant
3,36 · 10-9 vid 25 ºC.
Hårdhet
-3.0 (Calcite)
-3.5 - 4.0 (aragonite) på Mohs -skalan.
Fasövergångar
Aragoniten är metastabla och irreversibelt förändring till kalcit när den värmer den i torr luft till 400 ºC.
Reaktivitet
Kalciumkarbonat reagerar med syror och frisätter koldioxid, joniskt kalcium och vatten.
Kalciumkarbonat kombineras med mättat vatten med koldioxid, motsvarande kolsyra (h2Co3), För att bilda kalciumbikarbonat.
Träning
Krita, marmor och kalksten, de två första mineralerna och ett stenigt material som det tredje, innehåller kalciumkarbonat och är av sedimentärt ursprung, de tros bildas av sedimentationen av sniglar i miljoner år av år.
PH kan vara den viktigaste faktorn i bildningen av polymorfer vid en temperatur av 24 ° C. Vaterita är huvudprodukten i ett pH -intervall mellan 8,5 och 10; Aragonite är pH 11; och kalciten till pH> 12.
Det är också känt att många färskvattenalger bygger kalcitkristaller när de växer i en kalciummättad miljö. Dessutom kan mikroalger orsaka utfällning av kalciumkarbonat.
Kalciumkarbonatformer
I bilderna nedan kommer de tre huvudformerna eller polymorferna att visas för kalciumkarbonat:
 Calcita crystal. Källa: Förälder Géry [Public Domain]
Calcita crystal. Källa: Förälder Géry [Public Domain] Aragonitkristall. Källa: Battistini Riccardo [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]
Aragonitkristall. Källa: Battistini Riccardo [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] Vaterita kristaller. Källa: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Vaterita kristaller. Källa: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Från toppen är kalcit-, aragonit- och vaterita -polymorferna. Notera skillnaden mellan morfologin hos deras kristaller (färgen är typisk för dess ursprung och egenskaper hos dess miljöer).
Vaterita är mer ogenomskinlig än kalciten, den senare blir till och med fullständig. Samtidigt liknar aragonitkristallerna små långsträckta monoliter.
Om prover av dessa tre polymorfer observeras under det elektroniska mikroskopet, deras kristaller (av gråaktiga toner eftersom tekniken inte tillåter färgupplösning), skulle samma morfologier hittas som i makroskopiska skalor; det är vid första anblicken.
Bland dessa tre polymorfer är kalciten den vanligaste och stabila, följt av aragoniten, och slutligen Vaterita, den sällsynta av formerna av Caco3
Kan tjäna dig: kalorimetri: vilka studier och applikationerAnsökningar
Industriister
Kalciumkarbonat ökar resistensen mot vridning och dragkraft av syntetiskt och naturligt gummi, vilket bibehåller dess flexibilitet. Det används i byggbranschen som en cementingrediens och som råmaterial för lime. Användningen har minskats eftersom den skadas av surt regn.
Kalciumkarbonat används vid järnrening. I form av kalk eliminerar svaveldioxiden i metallen. Betarrening används. Det användes som en krita för skiffer, men har ersatts av gipsen för denna applikation.
Kalciumkarbonat blandas med kitt som används vid placering av glas. Mark används som fyllningsmaterial i den mikroporösa filmen som används i blöjor. Det används också som fyllningsmaterial i plast som PVC. Dessutom ökar styrkan hos plast.
Kalciumkarbonat används för att öka målningens täckningskapacitet. Det används som pappersfyllningsmaterial eftersom det är billigare än träfiber, att kunna representera mer än 10% av papperet.
Läkare
Det används som en antacida för att bekämpa gastrisk hyperakiditet och lindra matsmältningsbesvär. Det används som ett dietkalciumtillskott och vid behandling och förebyggande av osteoporos. Det används vid behandling av hyperfosfati hos patienter med kronisk njursvikt.
Det har använts för att minska de oönskade effekterna av proteashämmare som används vid behandling av HIV, observerar hos patienter en minskning av diarré.
Det ger en minskning av blodtrycket hos gravida kvinnor med hypertoni och preeklampsi, eftersom båda kan vara förknippade med en ökning av kalciumbehovet på grund av fostrets närvaro.
Andra
Kalciumkarbonat används i jordbruket som gödningsmedel och för att bekämpa jordens surhet. Det används som konserveringsmedel, färghållare och bekräftar mat.
Dessutom är det en ingrediens i tandkräm och fungerar som slipande damm i rengöring och tvätt.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Wikipedia. (2019). Karbonatkalcium. Hämtad från: i.Wikipedia.org
- Nationellt centrum för bioteknikinformation. (2019). Karbonatkalcium. Pubchemdatabas., CID = 10112. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Kai-Yin Chong, Chin-Hua Chia och Sarani Zakaria. (2014). Polymorfer Kalciumkarbonat vid temperaturreaktion. AIP -konferensförfaranden 1614, 52; doi.org/10.1063/1.4895169
- Greg Watry. (1 november 2016). Att upptäcka hur karbonatkristaller får styrka. Fördelar på affärsmarknadsföring. Återhämtat sig från: rdmag.com
- Amerikanska element. (2019). Karbonatkalcium. Hämtad från: Americanements.com
- Annars. (2019). Karbonatkalcium. Vetenskaplig. Hämtad från: Scientedirect.com
- Kemisk bok. (2017). Karbonatkalcium. Återhämtat sig från: Chemicalbook.com

