Natriumkarbonat (Na2CO3)
- 3434
- 1075
- Prof. Erik Johansson
Vi förklarar vad natriumkarbonat, dess fysiska och kemiska egenskaper, struktur och tillämpningar är
 Natriumkarbonatstruktur och formel
Natriumkarbonatstruktur och formel Vad är natriumkarbonat?
han natriumkarbonat (Na2Co3) Det är ett oorganiskt salt, alkaliskt metall och kolsyra. Han är också känd över hela världen som Sosa Ash. Sjöar och vulkanaktiviteter berikade natriumjordar, av vilka växterna var närade; Sedan, efter en brand, sprider dessa växter karbonataska.
Hur uppstår detta metalliska natriumsalt? Pure Natrium har en Valencia -konfiguration [NE] 3S1. 3s orbital elektron1 Det är lätt fristående av andra naturelement (såsom svavel, syre, klor, fluor, etc.), bildar mineralföreningar där den stabila jonen na deltar+.
Då en+ Det åtföljs av andra joniska arter i dessa fasta ämnen; Av dessa är natriumkarbonat bara en närvarande i naturen. Sedan dess har det använts i alla civilisationer under hela tiden. Dessa civilisationer fann i att grå damm gynnsamma egenskaper för sina hem och människor.
Dessa egenskaper markerade deras användning, som idag upprätthåller traditionella aspekter av det förflutna, och andra tillgodoser de nuvarande behoven.
Natriumkarbonat är mycket rikligt i naturen, och kanske också i andra territorier utanför planeten Jorden, till exempel några av solsystemets månar.
Formel
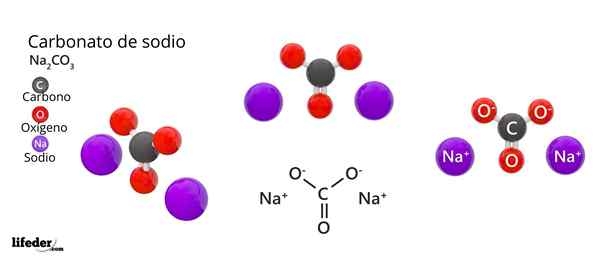
Den kemiska formeln för natriumkarbonat är NA2Co3. Hur tolkas det? Det betyder att i det kristallina fasta ämnet för varje samarbete32- Det finns två najoner+.
Natriumkarbonatstruktur
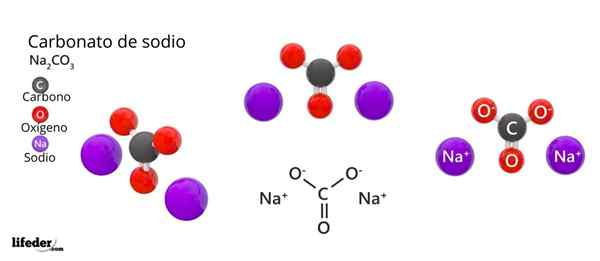
I den övre bilden representeras NA: s struktur2Co3 Anhydrid (även kallad Sosa Calcinada). Lila sfärer motsvarar najoner+, Medan svart och rött till jonerna Co32-.
Karbonatjoner har en platt trigonal struktur, med syreatomer vid deras toppar.
Det kan tjäna dig: Cinamic Acid: Struktur, egenskaper, erhållning, användningBilden ger ett panorama sett från ett högre plan. Najoner+ De är omgiven av sex syreatomer, från co -ioner32-. Det är i NA2Co3 Anhydrid Natrium möter en oktaedral koordinationsgeometri (den är låst i mitten av en oktaedron).
Denna struktur kan emellertid också hysa vattenmolekyler, interagera med vätebroar med topparna i trianglarna.
I själva verket hydrater2Co3 (Na2Co3· 10 timmar2Eller, na2Co3· 7h2Eller, na2Co3· H2Eller, och andra) är av större överflöd än anhydridsalt.
Termonatriten (NA2Co3· H2O), natronen (na2Co3· 10 timmar2O) och trona (na3(HCO3) (CO3) · 2h2Eller är de viktigaste naturliga källorna till natriumkarbonat, särskilt trona -mineralet, representerade i den första bilden.
Användning/tillämpningar av natriumkarbonat
Natriumkarbonat uppfyller många funktioner hos människor, hushåll och industri, bland dessa funktioner står följande ut:
- Natriumkarbonat används i många rengöringsprodukter. Detta beror på dess desinfektionsförmåga, dess kraft att lösa upp fett och deras egendom för att mjukgöra vatten. Det är en del av tvättmedel som används i tvättstugor, automatisk diskmaskin, rent glas, fläckar omrörning, blekare etc.
- Karbonatdesinfektionsmedel kan användas på icke -genom hårda ytor, såsom golv, väggar, porslin och badkar, med undantag för Glasfiber och aluminium, som kan repas av honom.
- Det används i vissa livsmedel för att undvika kopphyllan som kan uppstå i dessa.
- Det finns i flera produkter för personlig vård, som bubbelbad, tandpasta och tvålar.
- Det används i glasindustrin på grund av dess förmåga att bryta ner silikater.
- Det används vid underhåll av simbassänger, där det uppfyller en desinfektionsmedel och reglerande funktion av pH.
- Hos människor som terapeutiskt används vid behandling av surhet och dermatit.
- I veterinärmedicin används det vid behandling av ringmask och hudrengöring.
Natriumkarbonatsyntes

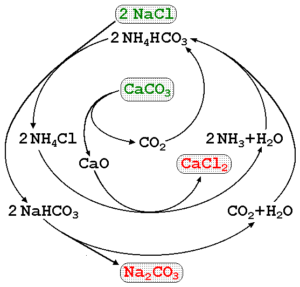
Natriumkarbonat kan tillverkas med saltlösning av havet och kalkstenen (Caco3) I Solvay -processen. I den överlägsna bilden illustreras ett processdiagram på att påpeka produktionsvägarna, liksom reagens, mellanhänder och produkter. Reagensen är skriven med gröna bokstäver och produkterna med röda bokstäver.
Övervakningen av dessa reaktioner kan vara lite komplicerad, men den globala ekvationen som endast indikerar reagens och produkter är:
2NACL (AQ) + Caco3(S) Na2Co3(S) + CaCl2(Ac)
Caco3 Den har en mycket stabil kristallin struktur, så den kräver ständigt mycket energi att sönderdelas i CO2. Dessutom genererar denna process stora mängder CaCl2 (kalciumklorid) och andra föroreningar, vars utsläpp påverkar kvaliteten på vatten och miljön.
Det finns också andra metoder för natriumkarbonatproduktion inom industrifält, såsom Hou- och LeBlanc -processer.
Idag är det att få sina naturliga mineraler hållbart, trona är den vanligaste av dessa.
Å andra sidan bestod den mest traditionella metoden av odling och förbränning av växter och alger som är rika på natrium. Sedan badades asken med vatten och utsattes för uppvärmning tills produkten. Härifrån kom Sosas berömda aska.
Natriumkarbonategenskaper
Då en2Co3 Det är ett hygroskopiskt vitt fast ämne, toalett, med en molekylvikt av 106 g/mol och en densitet av 2,54 g/ml vid 25 ° C.
Dess egenskaper förändras när en vattenmolekyl integreras i dess kristallina struktur. Eftersom vatten kan bilda vätebroar och jonerna "öppet utrymme" mellan dem, ökar glasets volym och hydratets densitet minskar. Till exempel för NA2Co3· 10 timmar2Eller dess densitet är 1,46 g/ml.
Kan tjäna dig: reversibel reaktion: egenskaper och exempelDå en2Co3 smälter vid 851 ºC och sönderdelas enligt följande ekvation:
Na2Co3(s) => na2Eller (s) + co2(g)
Återigen, trots samjonerna32- och na+ De skiljer sig åt i storlekar, deras elektrostatiska interaktioner är mycket effektiva och upprätthåller ett stabilt kristallint nätverk.
Vattenmolekyler "hindrar" dessa interaktioner och som ett resultat är hydrater mer mottagliga för sönderfallande än anhydrid.
Det är ett grundläggande salt; det vill säga upplöst i vatten genererar en lösning med ett pH större än 7. Detta beror på hydrolysen av CO32-, vars reaktion frigör oh- i mitten:
Co32-(Ac) + h2Eller (l) hco3-(AC) + OH-(Ac)
Det är mycket lösligt i vatten- och polära lösningsmedel, såsom glycerol, glycerin, aceton, acetater och flytande ammoniak.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. I grupp 1 -element. (Fjärde upplagan., p. 265). MC Graw Hill.
- Scifun.org. (2018). Natriumvätekarbonat och natriumkarbonat. Återhämtat sig från SCIFUN.org
- Wikipedia. (2018). Natriumkarbonat. Hämtas från.Wikipedia.org
- Pub. (2018). Natriumkarbonat. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov
- Ciner Resources Corporation. (2018). Sodaaska. Ciner återhämtade sig.oss.com
- Peltier k. (3 juli 2018). Allt du behöver veta om natriumkarbonit. Hämtad den 8 april 2018, från: thespruce.com
- Nettoindustri. (2018). Natriumkarbonat - Användning av natriumkarbonat. Hämtad den 8 april 2018, från: Science.skrov.org

