Natriumcyanid (NACN) struktur, egenskaper, risker, användningar

- 3927
- 1251
- Hans Olsson
han Natriumcyanid Det är ett oorganiskt salt som bildas av en natriumnation+ och en cyanidanjon CN-. Dess kemiska formel är NACN. Även känd som natriumcyanid, det är ett vitt kristallint fast ämne. Det är hygroskopiskt, det vill säga det absorberar vatten från miljön, och dess kristaller är kubiska såsom natriumklorid NaCl.
När det löses i vatten tenderar det att bilda HCN -vätecyanid. Hans lösningar löses lätt ut guld och silver. Denna funktion gör att den används för att extrahera guld och silver från sina mineraler. De lösningar som används för detta ändamål återvinns, det vill säga de återanvänds flera gånger.
 Natrium natriumcyanid. L26 [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons.
Natrium natriumcyanid. L26 [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons. Vissa cyanid lyckas dock undkomma vissa avfallsdammar, som representerar en fara för fauna och människa, eftersom cyanid är mycket giftig och kan orsaka dödsfall.
NACN används i den kemiska industrin som en mellanhand för att förbereda flera typer av föreningar, såsom färgämnen, kemikalier för jordbruk och läkemedel eller mediciner.
Natriumcyanid är en mycket farlig förening eftersom den kan orsaka dödsfall, så det måste manipuleras med extrem försiktighet.
[TOC]
Strukturera
Natriumcyanid bildas av en jon Na+ och en jon CN-.
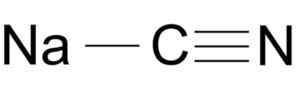 Natriumcyanidmolekylstruktur NACN. Arrowsmaster [Public Domain], källa: Wikimedia Commons.
Natriumcyanidmolekylstruktur NACN. Arrowsmaster [Public Domain], källa: Wikimedia Commons. Cyanidjonen har en bilbil och en av kväve n förenad av varandra av en trippellänk.
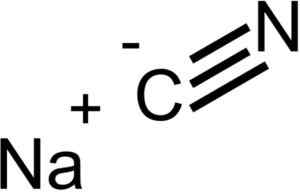 Joner som utgör natriumcyanid -NACN. EPOP [Public Domain]. Källa: Wikimedia Commons.
Joner som utgör natriumcyanid -NACN. EPOP [Public Domain]. Källa: Wikimedia Commons. NACN har samma kristallina struktur som NaCl, så dess kristaller är kubiska.
Nomenklatur
-Natriumcyanid
-Natriumcyanid
Egenskaper
Fysiskt tillstånd
Hygroskopiskt vitt kristallint fast ämne (absorbera vatten från miljön).
Molekylvikt
49,007 g/mol
Smältpunkt
563,7 ºC
Kokpunkt
1496 ºC
Flampunkt
Det är inte brandfarligt. Men om det utsätts för en brand förekommer HCN vätecyanid och kväveoxider.
Kan tjäna dig: sublimering: koncept, process och exempelDensitet
1 595 g/cm3 vid 20 ºC
Löslighet
Mycket löslig i vatten: 48 g/100 ml vid 10 ° C, 82 g/100 ml vid 35 ° C. Lite lösligt i alkohol
Dissociationskonstant
Det är hydrolyserat i vattenlösning som genererar HCN -vätecyanid. Konstanten för denna hydrolys är kh = 2,5 x 10-5.
pH
NACN -vattenhaltiga lösningar är starkt alkaliska
Kemiska egenskaper
När den upplöses i vatten separeras det i sina najoner+ och CN-. I vattenlösning Cyanidjon CN- Ta en proton h+ av vatten h2Eller bildar HCN och en OH -jon-, Så lösningen blir alkalisk.
Cn- + H2O → HCN + OH-
Av denna anledning sönderdelas deras vattenhaltiga lösningar snabbt genom att förbli lagrade och bilda HCN -vätescyanid.
Det är frätande mot aluminium. Dess lösningar löser enkelt upp AU och silver Ag i närvaro av luft.
Det är ett kelaterande medel eftersom cyanidanjonen CN- Det kan enkelt gå med andra metaller, såsom silver, guld, kvicksilver, zink, kadmium, etc.
Presenterar en svag lukt av bittera mandlar.
Risker
Måste hanteras mycket noggrant. Det är en mycket giftig förening, hämmar viktiga metaboliska processer och leder till döden både för intag, inandning, hudabsorption eller ögonkontakt.
Om NaCN inhaleras, löses den i slemhinnan i luftvägarna och passerar till blodomloppet. Cyanidjonen av NACN har en stark affinitet för järn i ett tillstånd av oxidation av +3, det vill säga järnkatjonens tro3+.
När cyanid absorberas reagerar den snabbt med tro3+ av ett viktigt enzym av mitokondrierna i cellerna (oxidascytokrom), vilket förhindrar att vissa andningsprocesser genomförs.
Därför hämmas eller bromsar cellulär andning och är cytotoxisk hypoxi. Det betyder att celler och vävnader inte kan använda syre, särskilt hjärn- och hjärtceller.
På detta sätt inträffar permanent eller dödlig skada på kroppen. Detta kan hända både hos människor och djur.
Om överbelastningen av blodkärl och korrosion av magslemhinnan intar, utöver vad som redan har nämnts.
Kan tjäna dig: Justus von Liebig Natriumcyanid NACN kan orsaka dödsfall. Författare: Openicons. Källa: Pixabay.
Natriumcyanid NACN kan orsaka dödsfall. Författare: Openicons. Källa: Pixabay. Det är inte bränsle, men i kontakt med syror släpper det HCN som är mycket brandfarligt och giftigt.
Om det smälter med nitriter eller klorater kan det utnyttja.
Erhållande
Det kan erhållas med natrium Na, ammoniak NH3 och kol C. Natriumet reagerar med ammoniak som ger natrium nanh2:
2 Na + 2 NH3 → 2 Nanh2 + H2↑
Natriumamid värms upp med kol vid 600 ° C och producerar natriumcyanamid Na2NCN, som sedan med kol vid 800 ° C blir natriumcyanid:
2 nanh2 + C → 2 h2↑ + na2Ncn
Na2NCN + C → 2 NACN
En annan metod är att smälta kalcium och kolcyanamid C med natriumkarbonat Na2Co3:
Cancer + c + na2Co3 → Caco3 + 2 Nacn
Det kan också framställas genom att passera kvävegas n2 För en varm blandning av natriumkarbonat2Co3 och kol C pulveriserat, med tro tro som en katalysator eller accelerator för reaktionen:
Na2Co3 + 4 c + n2 → 2 NaCn + 3 CO ↑ 2
Ansökningar
Vid utvinning av guld- och silvermineraler. Konsekvenser
Natriumcyanid har använts under lång tid för att extrahera guld- och silvermetaller från dess mineraler.
Cyaniden som används i processen återvinns, men något undgår avfallsdammet tillsammans med tungmetallerna som inte återhämtas.
Fåglar, fladdermöss och andra djur som dricker från dessa laguner med cyanid har förgiftats.
Det finns register över en Rumäniens damm som höll ett avfallsdamm isolerat och skadades av en väderhändelse.
Som en konsekvens släpptes massor av cyanid till floden Sasar och närliggande akvifersystem som Lapus, Somes, Tisza Rivers, som slutade i Donau.
Detta orsakade ett vattenfall av djurdödsfall, eller med andra ord, en ekologisk katastrof.
 Guldekstraktion med cyanid i Nya Zeeland omkring 1918. Du kan se mängden förorenat vatten, som släpptes i de närliggande floderna. National Library NZ på Commons [inga begränsningar]. Källa: Wikimedia Commons.
Guldekstraktion med cyanid i Nya Zeeland omkring 1918. Du kan se mängden förorenat vatten, som släpptes i de närliggande floderna. National Library NZ på Commons [inga begränsningar]. Källa: Wikimedia Commons. Vid produktion av andra kemiska föreningar
Natriumcyanid -NACN används i syntesen av olika typer av organiska föreningar.
Kan tjäna dig: natriumoxid (Na2O): struktur, formel, egenskaper, riskerTill exempel bereds pigment och färgämnen (inklusive optiska polermedel), föreningar för användning i jordbruk eller jordbrukskemikalier och olika farmaceutiska produkter.
Det tjänar också till att få kelaterings- eller kidnappningsmedel av metalljoner.
Med natriumcyanid framställs föreningarna som kallas nitriler, som när de behandlas med sura syra eller alkalisk vattenlösning gör det möjligt att erhålla karboxylsyror.
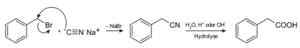 Beredning av en karboxylsyra med natriumcyanid NACN. Roland Mattern [Public Domain]. Källa: Wikimedia Commons.
Beredning av en karboxylsyra med natriumcyanid NACN. Roland Mattern [Public Domain]. Källa: Wikimedia Commons. Det gör det möjligt att förbereda fettsyror med cyanogrupper, tungmetallcyanider och vätecyanid HCN.
I metallbranschen
NACN används i de lösningar som används i galvanoplastik eller metallelektrod (metallbeläggning med andra) till exempel zink.
Det är en del av härdat stål. Det tjänar också vid rengöring av metaller.
I andra användningsområden
Natriumcyanid är en mellanhand i tillverkningen av nylon.
Det används för att separera mineraler genom flotation med skum.
Applikationer utan användning, ifrågasatt eller mycket sällsynt
Nationen användes för att eliminera gnagare, såsom kaniner och råttor och deras hålor, och för att avsluta termiter bon.
Det används för närvarande ibland för att eliminera coyoter, rävar och vilda hundar. Det används i form av kapslar som enkla eller flera doser i betesmarker, jakt och skogar.
På grund av dess extrema toxicitet måste NACN endast användas av förberedda personer.
Denna användning anses vara mycket farlig för människan, men det finns de som fortfarande använder den.
 Vilda livet bör inte elimineras, eftersom dessa djur redan kämpar för att överleva under svåra förhållanden. Författare: Maxwdhs. Källa: Pixabay.
Vilda livet bör inte elimineras, eftersom dessa djur redan kämpar för att överleva under svåra förhållanden. Författare: Maxwdhs. Källa: Pixabay. I jordbruket användes det tidigare för att fumigera citrusfruktträd och andra frukter. Det användes också som insekticid och miticid (kval eliminator) för att appliceras efter skörd, för icke -lagrad citrus eller för rökning av lastbilar som används för att transportera dem. Det användes också för att fumigera fartyg, järnvägsbilar och lager.
Alla dessa användningsområden har ifrågasatts av den höga toxiciteten hos natriumcyanid. Av denna anledning används den inte längre eller bara mycket sällan och under mycket kontrollerade förhållanden.
Referenser
- ELLER.S. National Library of Medicine. (2019). Natriumcyanid. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Kirk-THERMER (1994). Encyclopedia of Chemical Technology. Fjärde upplagan. John Wiley & Sons.
- Hurst, h.OCH. och Martin, m.D. (2017). Toxikologi. Cyanid. Inom farmakologi och terapeutik för tandvård (sjunde upplagan). Återhämtat sig från Scientedirect.com.
- Coppock, r.W. och dziwenka, m. (2015). Hot mot djurliv av kemiska krigsföringsmedel. I Handbook of Toxicology of Chemical Warfare Agents (andra upplagan). Återhämtat sig från Scientedirect.com.
- Morrison, r.T. och Boyd, r.N. (2002). Organisk kemi. Sjätte upplagan. Prentice-hall.
- « Svaveltrioxid (SO3) struktur, egenskaper, risker, användningar
- Bariumoxid (BAO) struktur, egenskaper, användningar, risker »

