Cyklobutanstruktur, egenskaper, användningar och syntes
- 2861
- 88
- Hans Olsson
han Cyklobutan Det är ett kolväte som består av en cyklokan med fyra kol, vars molekylformel är C4H8. Du kan också kallas tetrametylen med tanke på att det finns fyra FN -enheter2 som utgör en ring med fyrkantig geometri, även om cyklobutannamnet är mer accepterat och känt.
Vid rumstemperatur är det en färglös, brandfarlig gas som brinner med en ljus låga. Dess mest primitiva användning är som en värmekälla genom att bränna den; Emellertid täcker dess strukturella bas (torget) djupa biologiska och kemiska aspekter och samarbetar på ett visst sätt med egenskaperna hos nämnda föreningar.
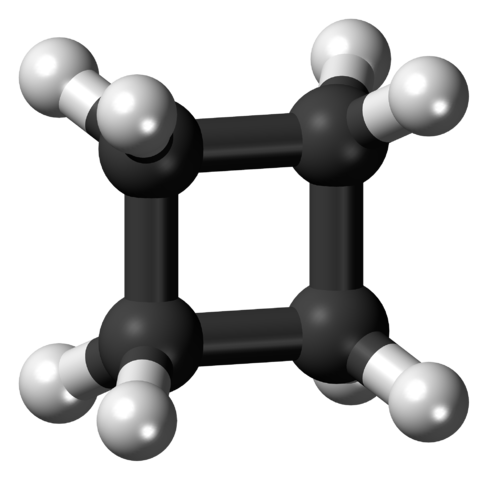 Cyklobutanmolekyl i spänd konformation. Källa: Jynto [CC0].
Cyklobutanmolekyl i spänd konformation. Källa: Jynto [CC0]. I den övre bilden visas en cyklobutanmolekyl med fyrkantig struktur. I nästa avsnitt kommer det att förklaras varför denna konformation är instabil, eftersom dess länkar är spända.
Efter cyklopropo är det den mest instabila cykloalcan, eftersom ju mindre storleken på ringen, desto mer reaktivt kommer det att vara. Enligt detta är cyklobutanen mer instabil än Pentan- och Hexano -cyklerna. Det är emellertid nyfiken att bevittna i sina derivat ett kärna eller ett fyrkantigt hjärta, som, som kommer att ses, är dynamiskt.
[TOC]
Cyklobutanstruktur
I den första bilden behandlades strukturen på cyklobutanen som en enkel kol och hydrerad fyrkant. På detta perfekta torg lider emellertid orbitalerna en allvarlig förorening av sina ursprungliga vinklar: de är separerade med en vinkel på 90º jämfört med 109,5º för en kolatom med spa -hybridisering SP3 (vinkelspänning).
Plat med bilkol3 De är tetrahedraler, och för vissa tetrahedra skulle det vara svårt att flexa båda deras orbitaler för att skapa en vinkel på 90º; Men det skulle vara ännu mer för kol med SP -hybridiseringar2 (120º) och SP (180º) avled dina ursprungliga vinklar. Av denna anledning har cyklobutan SP kolatomer3 i huvudsak.
Kan tjäna dig: Sekundär alkohol: Vad är, struktur, egenskaper, användningarVäteatomer är också mycket nära varandra, förmörkade i rymden. Detta resulterar i en ökning av steriskt hinder, vilket försvagar det påstådda fyrkanten för sin höga vridspänning.
Därför gör vinkel- och vridspänningar (inkapslade i termen "ringformad spänning") denna konformation instabil under normala förhållanden.
Cyklobutan.
Fjärilar eller skrynkliga konformationer
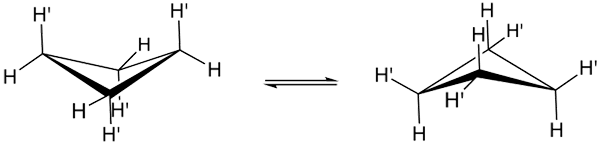 Cyklobutan konformationer. Källa: Smokefoot.
Cyklobutan konformationer. Källa: Smokefoot. De verkliga konformationerna av cyklobutano visas ovan. I dem minskar vinkel- och vridspänningar; Eftersom, som man kan se, inte alla väteatomer är förmörkade. Det finns emellertid en energikostnad: vinkeln på dess länkar förvärras, det vill säga lågt från 90 till 88º.
Observera att det kan jämföras med en fjäril, vars triangulära vingar bildas av tre kolatomer; och den fjärde, placerad i en vinkel på 25º med avseende på varje vinge. Double Sense Arrows påpekar att det finns en balans mellan båda konformerna. Det är som om fjärilen ner och klättrar på vingarna.
Hos de härrörande från cyklobutanen å andra sidan kan det förväntas att denna fladder skulle bli mycket långsammare och rumsligt förhindrad.
Intermolekylär interaktioner
Anta att du glömmer några ögonblick av rutorna och ersätter dem på plats med kolsyrade fjärilar. Du är i deras fladder kan bara hållas tillsammans i vätskan med hjälp av London -spridningskrafter, som är proportionella mot deras vingar och dess molekylmassa.
Det kan tjäna dig: karbonylgrupp: egenskaper, egenskaper, nomenklatur, reaktivitetEgenskaper
Fysiskt utseende
Färglös gas.
Molekylär massa
56,107 g/mol.
Kokpunkt
12,6ºC. Därför kan det under kalla förhållanden i princip manipuleras som alla vätskor; Med den enda detalj, att den skulle vara mycket flyktig, och deras ångor skulle fortfarande utgöra en risk att ta hänsyn till.
Smältpunkt
-91ºC.
antändningspunkt
50ºC en stängd kopp.
Löslighet
Olöslig i vatten, vilket inte är förvånad med tanke på dess apolära natur; Men det är något lösligt i alkoholer, eter och aceton, som är mindre polära lösningsmedel. Det förväntas vara lösligt (men inte rapporterat) logiskt i apolära lösningsmedel såsom koltetraklorid, bensen, xylen, etc.
Densitet
0,7125 till 5 ° C (i förhållande till 1 från vatten).
Ång-densitet
1,93 (i förhållande till 1 i luften). Detta innebär att det är tätt än luften, och därför, såvida det inte finns strömmar, kommer dess trend inte att stiga upp.
Ångtryck
1.180 mmHg vid 25 ° C.
Brytningsindex
1 3625 till 290 ° C.
Förbränningsentalpi
-655,9 kJ/mol.
Formvärme
6,6 kcal/mol a 25 ° C.
Syntes
Cyklobutanen syntetiseras genom hydrering av cyklobutadien, vars struktur är nästan densamma, med den enda skillnaden att den har en dubbelbindning; Och därför är det ännu mer reaktivt. Detta är kanske den enklaste syntetiska vägen att få den, eller åtminstone bara för honom och inte till ett derivat.
I råoljan är det osannolikt att få eftersom det skulle reagera på ett sådant sätt att det bröt ringen och linjekedjan bildades, det vill säga n-butan.
En annan metod för att erhålla cyklobutan är att påverka ultraviolett strålning på etenmolekyler, CH2= Ch2, som mäts. Denna reaktion är fotokemiskt gynnad, men inte termodynamiskt:
Kan tjäna dig: Benchilo Benzoate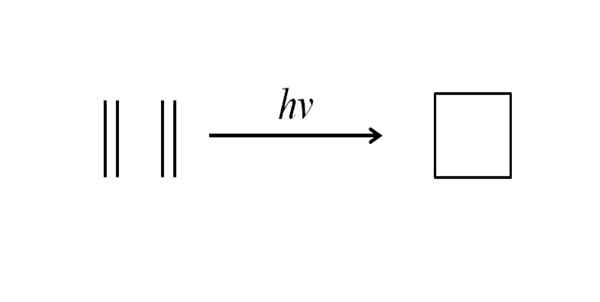 Cyklobutansyntes av ultraviolett strålning. Källa: Gabriel Bolívar.
Cyklobutansyntes av ultraviolett strålning. Källa: Gabriel Bolívar. Den övre bilden sammanfattar vad som sades i stycket ovan. Om det istället för eten var till exempel alla två alkener, skulle en ersatt cyklobutan erhållas; eller vad är detsamma, ett cyklobutanderivat. Faktum är att många derivat med intressanta strukturer har syntetiserats genom denna metod.
Andra derivat innebär emellertid en serie komplicerade syntetiska steg. Därför är Cyclobuta (som deras derivat kallas) föremål för att studera för organisk syntes.
Ansökningar
Cyclobutan ensam har inte mer användning än att tjäna som en värmekälla; Men dess derivat ingår intrikata länder i organisk syntes, med applikationer inom farmakologi, bioteknik och medicin. Utan att fördjupa för komplexa strukturer är penitrems och grandisol exempel på cyklobutaner.
Cyklobutaner har i allmänhet egenskaper som är fördelaktiga för metabolismerna av bakterier, växter, marina ryggradslösa djur och svampar. De är biologiskt aktiva, och det är därför deras användning är mycket varierande och svåra att specificera, eftersom var och en har sin speciella effekt på vissa organismer.
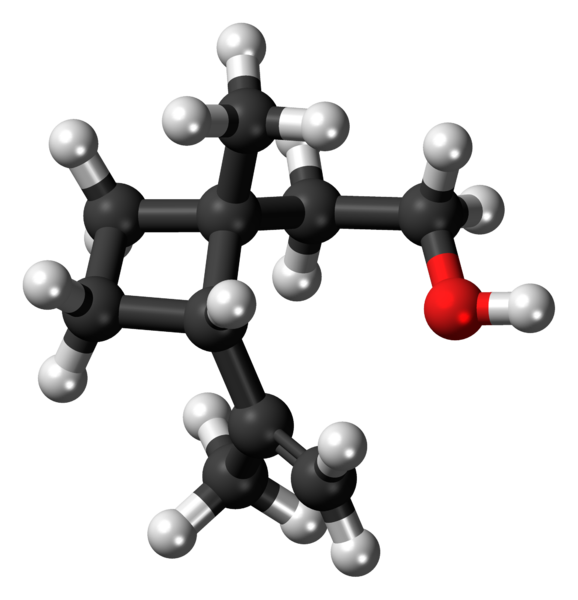
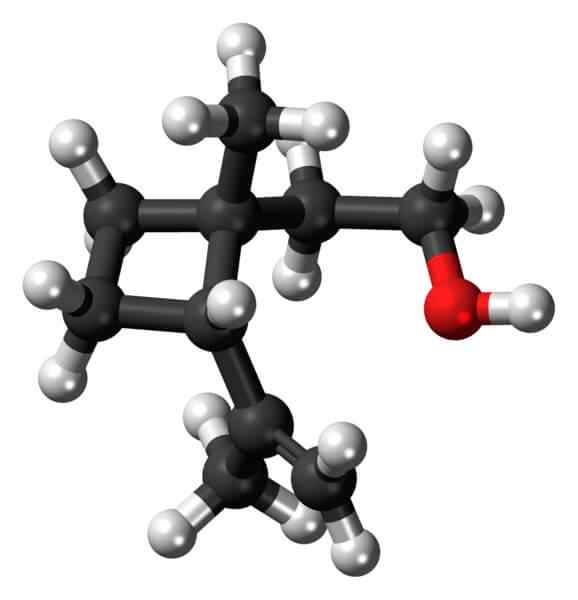 Grandisol: Ett exempel på ett cyklobutanderivat. Källa: Jynto [CC0].
Grandisol: Ett exempel på ett cyklobutanderivat. Källa: Jynto [CC0]. Grandisol är till exempel en gorgjo -feromon (en typ av skalbagge). Ovan, och slutligen, dess struktur visas, betraktas som en monoterpen med en kvadratisk bas av cyklobutan.
Referenser
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Graham Solomons, T.W.; Craig b. Fryhle. (2011). Organisk kemi. (elvath utgåva). Wiley.
- Wikipedia. (2019). Cyklobutan. Hämtad från: i.Wikipedia.org
- Pub. (2019). Cyklobutan. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Peiris Nicole. (29 november 2015). Cykloalkanernas fysiska egenskaper. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Wiberg b. Kenneth. (2005). Cyklobutan-fysiska egenskaper och teoretiska studier. Institutionen för kemi, Yale University.
- Klement foo. (s.F.). Cyklobutaner i organisk syntes. Hämtad från: Scripps.Edu
- Myers. (s.F.). Cyklobutanesyntes. Chem 115. Återhämtat sig från: hwpi.Sköre.Edu
- « Silver Bromuro (AGBR) struktur, egenskaper och användningar
- Syntetiska läkemedel Egenskaper, typer och effekter »

