Silver Bromuro (AGBR) struktur, egenskaper och användningar
- 1979
- 251
- Per Karlsson
han Silverbromid Det är ett oorganiskt salt vars kemiska formel är agbr. Dess fasta består av AG -katjoner+ Och Br Aniss- I en 1: 1 -andel, lockad av elektrostatiska krafter eller av joniska länkar. Det kan ses som om metallsilver hade gett en av sina valenselektroner till molekylbroman.
Hans natur liknar hans "bröder" -klorid och silver yoduro. De tre salterna är olösliga i vatten, de har liknande färger och dessutom är de känsliga för ljus; det vill säga de lider av fotokemiska reaktioner. Den här egenskapen har använts för att få fotografier, resultatet av minskningen av agjoner+ till metallsilver.
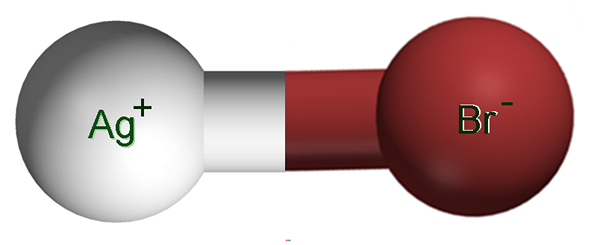
 Silverbromidjoner. Källa: Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]
Silverbromidjoner. Källa: Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] I den övre bilden visas ett agjoniskt par+Bras-, där de vita och bruna sfärerna motsvarar agjonerna+ och br-, respektive. Här representerar de den joniska bindningen som AG-BR, men det är nödvändigt att indikera att det inte finns någon sådan kovalent bindning mellan båda jonerna.
Det kan verka motsägelsefullt att silver är den som ger den svarta färgen på de färglösa fotografierna. Detta beror på att AGBR reagerar med ljuset och genererar en latent bild; som sedan intensifieras genom att öka silverreduktionen.
[TOC]
Silverbromidstruktur
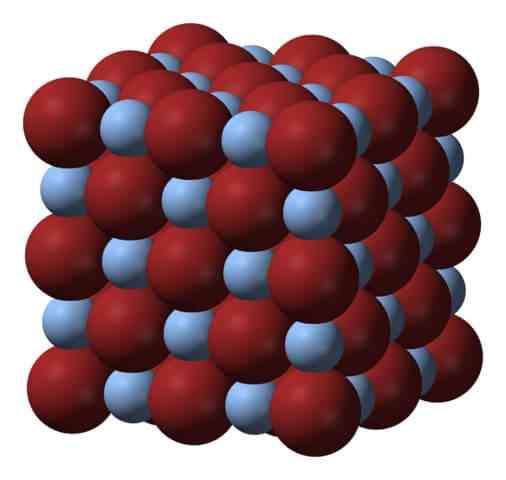 Kristallin struktur av silverbromid. Källa: Benjah-Bmm27 via Wikipedia.
Kristallin struktur av silverbromid. Källa: Benjah-Bmm27 via Wikipedia. Ovanför nätverket eller den kristallina strukturen i silverbromiden. Här visas en mer trogen representation av storleksskillnaden mellan de joniska radionerna för Ag+ och br-. BR -anjoner-, mer skrymmande, lämna interstices där ag -katjoner är belägna+, som är omgiven av sex br- (och vice versa).
Denna struktur är karakteristisk för ett kubiskt kristallint system, specifikt salttyp; detsamma, till exempel, för natriumklorid, NaCl. Faktum är att bilden underlättar detta genom att ha en perfekt kubisk gräns.
Kan tjäna dig: Referenselektrod: Egenskaper, funktion, exempelVid första anblicken kan det noteras att det finns någon skillnad i storlek mellan joner. Detta, och kanske de elektroniska egenskaperna hos AG+ (och av den möjliga effekten av vissa föroreningar) leder det till AGBR -kristaller som presenterar defekter; Det vill säga webbplatser där jonbeställningssekvensen i rymden är "pauser".
Kristallina defekter
Dessa defekter består av luckor som lämnats av frånvarande eller fördrivna joner. Till exempel bland sex BR -anjoner- Normalt bör vara krineringens ag+; Men istället kan det finnas ett vakuum eftersom silver har flyttat till ett annat interstitium (Frenkel -defekt).
Även om de påverkar det kristallina nätverket föredrar de silverreaktioner med ljus; Och ju större kristaller eller deras kluster (kornstorlek), desto större är antalet defekter, och därför kommer det att vara mer känsligt för ljus. På samma sätt påverkar föroreningarna strukturen och denna egenskap, särskilt de som kan minskas med elektroner.
Som en följd av det senare kräver AGBR: s stora kristaller lägre exponering för ljus för att minska; det vill säga de är mer önskvärda för fotografiska ändamål.
Syntes
I laboratoriet kan du syntetisera silverbromiden som blandar en vattenlösning av silvernitrat, AGNO3, Med natriumbromidsalt, nabab. Det första saltet ger silver och den andra bromiden. Följande är en dubbelförskjutning eller metatesreaktion som kan representeras med den kemiska ekvationen nedan:
Agno3(aq) + nabab (s) => nano3(aq) + agbr (s)
Det kan tjäna dig: natriumbromid (NABR)Observera att saltnitratsaltet, nano3, Det är lösligt i vatten, medan AGBR fälls ut som ett fast ämne med en svag gul färg. Därefter tvättas det fasta ämnet och genomgår vakuum. Förutom NABB kan KBR också användas som en källa till bromurösa anjoner.
Å andra sidan kan AGBR erhållas genom dess Bromirita -mineral och dess förenliga reningsprocesser.
Egenskaper
Utseende
Lera gult fast ämne som liknar en lera.
Molekylär massa
187,77 g/mol.
Densitet
6 473 g/ml.
Smältpunkt
432 ° C.
Kokpunkt
1502 ° C.
Vattenlöslighet
0,140 g/ml vid 20 ° C.
Brytningsindex
2 253.
Värmekapacitet
270 j/kg · k.
Lätt känslighet
Det sades i föregående avsnitt att i AGBR -kristallerna finns defekter som främjar känsligheten hos detta salt i ljus, eftersom de fångar de elektronerna bildade; Och så, i teorin, hindrar de dem från att reagera med andra arter i mitten, till exempel luftsyre.
Elektronen frigörs från BR -reaktionen- Med en foton:
Bras- + Hv => 1/2br2 + och-
Observera att det finns en2, som färgar det fasta röda om det inte tas bort. Frigörda elektroner minskar Ag -katjoner+, I dess mellanrum, metalliskt silver (ibland representerat som AG0):
Ag+ + och- => Ag
Sedan har nettoekvationen:
AGBR => AG + 1/2BR2
När de "första skikten" av metallsilver på ytan bildas, sägs det att det finns en latent bild, fortfarande osynlig för det mänskliga ögat. Denna bild görs miljoner gånger mer synlig om en annan kemisk art (såsom hydrokinon och fenidon, i utvecklingsprocessen) ökar minskningen av AGBR -kristaller till metalliskt silver
Det kan tjäna dig: kol 12: Nuclear Notation, History, CommentsAnsökningar
 Svartvitt fickklockfotografering. Källa: Pexels.
Svartvitt fickklockfotografering. Källa: Pexels. Silverbromid är den mest använda av alla dess halider inom uppenbarelsen av fotografiska filmer. AGBR appliceras på dessa filmer, tillverkade med cellulosaacetat, suspenderat i en gelé (fotografisk emulsion) och i närvaro av 4- (metylering) fenolsulfat (metol) eller fenidon och hydrokinon.
Med alla dessa reagens kan livet ges till den latenta bilden; Slutför och påskynda omvandlingen av jonisk till metallsilver. Men om du inte fortsätter med viss vård och erfarenhet kommer allt ytsilver att oxideras, och kontrasten mellan de svarta och vita färgerna kommer att sluta.
Det är därför de är viktiga i badrummen för arbetslöshet, fixering och tvätt, av fotografiska filmer.
Det finns konstnärer som leker med dessa processer på ett sådant sätt att de skapar grå nyanser, vilket berikar bildens skönhet och sin egen arv; Och allt detta gör, ibland kanske utan att misstänka det, tack vare kemiska reaktioner, vars teoretiska grund kan bli lite komplex och en lättkänslig AGBR och som markerar en utgångspunkt.
Referenser
- Wikipedia. (2019). Silverbromid. Hämtad från: i.Wikipedia.org
- Michael W. Davidson . (13 november 2015). Polariserat lätt digitalt bildgalleri: Silverbromid. Olympus. Återhämtad från: mikro.Magnet.Fsu.Edu
- Crystran Ltd. (2012). Silverbromid (AGBR). Återhämtat sig från: Crystran.co.Storbritannien
- Lothar Duenkel, Juergen Eichler, Gerhard Ackermann och Claudia Schneeweiss. (29 juni 2004). Självgjorda silverbromidbaserade emulsioner för användare inom holografi: Tillverkning, bearbetning och applikation, proc. SPIE 5290, PRAKTISK HOLOGRAFI XVIII: Material och applikationer; Doi: 10.1117/12.525035; https: // doi.org/10.1117/12.525035
- Alan G. Form. (1993). Oorganisk kemi. (Andra upplagan.). Redaktör.
- Carlos Güido och Ma Eugenia Bautista. (2018). Introduktion till fotografisk kemi. Återhämtat sig från: fotografering.Ceduc.com.mx
- Garcia d. Skön. (9 januari 2014). Kemi, fotografering och Chema Madoz. Återhämtat sig från: dimetylsulfuro.är
- « Hur man utbildar ett barn tillräckligt 13 praktiska råd
- Cyklobutanstruktur, egenskaper, användningar och syntes »

