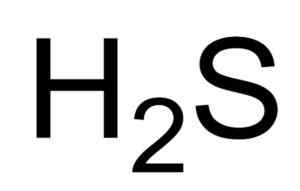
Sulfhydronsyra (H2S) struktur, egenskaper, användning, betydelse
- 2629
- 364
- Lars Eriksson
han sulfhydrionsyra o Vätesulfid är en gas som bildas av föreningen av en svavelatom (er) och två väteatomer (H). Dess kemiska formel är h2S. Det är också känt som sulfidgas. Det är en färglös gas vars lukt blir uppenbar i ruttna ägg.
Det finns i vulkaner och svavelhaltiga varma källor, i naturgas och råolja. Det bildas också under anaerob (utan syre) nedbrytning av växt- och djurens organiska material. Det förekommer naturligt i kroppen av däggdjur, genom verkan av vissa enzymer på cystein, en icke -essentiell aminosyra.
 Kemisk formel av sulfhydronsyra eller vätesulfid. Saranphong Yimklan [Public Domain]. Källa: Wikimedia Commons.
Kemisk formel av sulfhydronsyra eller vätesulfid. Saranphong Yimklan [Public Domain]. Källa: Wikimedia Commons. De vattenhaltiga lösningarna av h2S är frätande för metaller som stål. H2S är en reducerande förening som, när du reagerar med SO2 , Det oxiderar elementärt svavel medan det minskar till så2 Också för svavel.
Trots att det är en mycket giftig och dödlig förening för mänskliga och djur har dess betydelse studerats i en serie viktiga processer i kroppen.
Reglerar en serie mekanismer relaterade till generering av nya blodkärl och hjärtans funktion.
Skydda neuroner och har tänkt på dess handling mot sjukdomar som Parkinson och Alzheimers.
På grund av dess kemiska reducering kan han bekämpa oxiderande arter och därmed agera mot cellåldrande. På grund av dessa skäl studeras möjligheten att producera läkemedel att när de levereras till patienter kan långsamt frigöra den i kroppen.
Detta skulle tjäna till att behandla patologier som ischemi, diabetes och neurodegenerativa sjukdomar. Deras verkningsmekanism och deras säkerhet måste dock fortfarande undersökas i djupet.
[TOC]
Strukturera
H -molekulan2S är analog med vatten, det vill säga de liknar sin form eftersom hydrogener är belägna och bildar en vinkel med svavel.
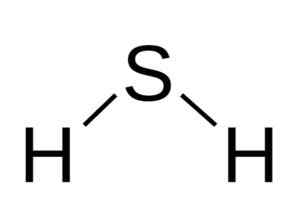 Vinkelstrukturen i sulfidsyramolekylen, h2S. Bangin [CC BY-SA 3.0 (http: // Creativecommons.Org/licenser/BY-SA/3.0/]]. Källa: Wikimedia Commons.
Vinkelstrukturen i sulfidsyramolekylen, h2S. Bangin [CC BY-SA 3.0 (http: // Creativecommons.Org/licenser/BY-SA/3.0/]]. Källa: Wikimedia Commons. Svavel i h2S har följande elektroniska konfiguration:
1s2, 2s2 2 p6, 3s2 3p6,
Ta sedan en elektron av varje väte för att slutföra sitt valenslager.
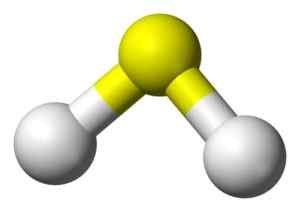 3D -struktur av sulfidsyra. Gul: Svavel. Vit: Väte. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons.
3D -struktur av sulfidsyra. Gul: Svavel. Vit: Väte. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons. Nomenklatur
- Sulfhydrionsyra
- Vätesulfid
- Svaveldydrid.
Fysikaliska egenskaper
Fysiskt tillstånd
Färglös gas med mycket obehaglig lukt.
Molekylvikt
34,08 g/mol.
Smältpunkt
-85,60 ºC.
Kokpunkt
-60,75 ºC.
Densitet
1,1906 g/l.
Löslighet
Måttligt vattenlösligt: 2,77 volymer i 1 vatten vid 20 ºC. Det kan kastas ut från den vattenhaltiga lösningen helt genom att skicka den till en koka.
Kemiska egenskaper
I vattenlösning
När vätesulfid är i vattenlösning tilldelas namnet på sulfhydronsyra. Det är en svag syra. Den har två joniserbara protoner:
H2S + h2Eller ⇔ h3ANTINGEN+ + Hs-, Ka1 = 8,9 x 10-8
Hs- + H2Eller ⇔ h3ANTINGEN+ + S2-, KA2 ∼ 10-14
Den första protonen är lätt joniserad, vilket kan härledas från dess första joniseringskonstant. Den andra protonen är väldigt lite joniserad, men H: s lösningar2S innehåller något av svavelanjonen s2-.
Om H -lösningen2S utsätts för luften, o2 Oxida till sulfidjon och svavel fälls ut:
Kan tjäna dig: oxider2 s2- + 4 h+ + ANTINGEN2 → 2 h2O + 2 s0↓ (1)
I närvaro av klor CL2, Bromo br2 och jod i2 Motsvarande väte och svavel bildas:
H2S + br2 → 2 hbr + s0↓ (2)
De vattenhaltiga lösningarna av h2S är frätande, producerar stresssprickor med sulfid i höga hårda stål. Korrosionsprodukter är järn- och vätesulfid.
Syrereaktion
H2S reagerar med luftens syre och följande reaktioner kan uppstå:
2 h2S + 3 o2 → 2 h2O + 2 så2 (3)
2 h2S + o2 → 2 h2O + 2 s0↓ (4)
Reaktion med metaller
Den reagerar med olika metaller som rör sig till väte och bildar metallsulfid:
H2S + PB → PBS + H2↑ (5)
Reaktion med svaveldioxid
I de vulkaniska gaserna finns H2S och så2, som reagerar med varandra och fast svavel bildas:
H2S + så2 → 2 h2O + 3 s0↓ (6)
Nedbrytning med temperatur
Vätesulfid är inte särskilt stabilt, den bryts lätt genom uppvärmning:
H2S → h2↑ + s0↓ (7)
Plats i naturen
Denna gas finns naturligtvis i sulfidiska eller svavelösa varma källor, i vulkaniska gaser, i råolja och naturgas.
 Svavelvattenmanantial. Николай максимович [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)]. Källa: Wikimedia Commons.
Svavelvattenmanantial. Николай максимович [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)]. Källa: Wikimedia Commons. När olja (eller gas) innehåller betydande spår av h2S sägs vara "sur", i motsats till "söt", vilket är när det inte innehåller det.
Små mängder h2S i olja eller gas är ekonomiskt skadliga eftersom en tvättverk måste installeras för att ta bort den, både för att förhindra korrosion och för att göra restgas säker för hushållsbruk som bränsle som bränsle.
Det inträffar när det organiska materialet som innehåller svavel sönderdelas under anaeroba förhållanden (frånvaro av luft), såsom mänskliga, djur och växtavfall.
 H utsläpp2S (blåaktig grön färg) vid Namibias kust, fotograferad av NASA. Dessa utsläpp kommer från organiskt avfall. NASA: s jordobservatorium [CC av 2.0 (https: // CreativeCommons.Org/licenser/av/2.0)]. Källa: Wikimedia Commons.
H utsläpp2S (blåaktig grön färg) vid Namibias kust, fotograferad av NASA. Dessa utsläpp kommer från organiskt avfall. NASA: s jordobservatorium [CC av 2.0 (https: // CreativeCommons.Org/licenser/av/2.0)]. Källa: Wikimedia Commons. De bakterier som finns i munnen och i mag -tarmkanalen producerar den från de nedbrytbara materialen som grönsaker eller animaliska proteiner innehåller.
Dess karakteristiska lukt gör att dess närvaro i ruttna ägg varnas.
H2S Det förekommer också i vissa industriella aktiviteter, till exempel i oljeraffinaderier, koksugnar, pappersfabriker, du skulle ha och i matbearbetning.
Syntes i kroppen av däggdjur
H2S endogent kan förekomma i däggdjursvävnader, bland dessa människan, med två stigar, en enzymatisk och en icke -enzymatisk.
Den icke -enzymatiska vägen består i att minska elementära svavel0 till H2S genom glukosoxidation:
2 c6H12ANTINGEN6 (glukos) + 6 s0 (svavel) + 3 h2O → 3 C3H6ANTINGEN3 + 6 h2S + 3 CO2 (8)
Kan tjäna dig: klor: historia, egenskaper, struktur, risker, användningarDen enzymatiska vägen består av h h2S från L-cysteinen, som är en aminosyras syntetiserad av kroppen. Processen är försäkrad av flera enzymer, såsom cystation.
 Sulfhydrinsyra har hittats i hjärnan hos kor. Författare: Arttower. Källa: Pixabay.
Sulfhydrinsyra har hittats i hjärnan hos kor. Författare: Arttower. Källa: Pixabay. Få i laboratoriet eller industriellt
Vätgasgas (h2) och svavelelementet reagerar inte på normala miljötemperaturer, men över dessa börjar de kombineras, den optimala temperaturen är 310 ºC.
Processen är ändå för långsam, så andra metoder används för att få den, bland dessa följande.
Metallsulfider (såsom järnhaltig sulfid) reagerar med syror (såsom vattenklor) i utspädd lösning.
FES + 2 HCl → FECL2 + H2S ↑ (9)
På detta sätt erhålls gasen2S som med tanke på dess toxicitet måste samlas in säkert.
Industriell användning av H2S för att producera svavel
Lagring och transport i stora mängder h2S som skiljer sig från naturgas genom tvätt med aminer är svårt, så klausprocessen används för att förvandla den till svavel.
 I oljeraffinaderierna separeras H2S naturgas genom tvätt med aminer och blir sedan svavel. Författare: Satyaprem. Källa: Pixabay.
I oljeraffinaderierna separeras H2S naturgas genom tvätt med aminer och blir sedan svavel. Författare: Satyaprem. Källa: Pixabay. I denna process inträffar två reaktioner. I den första h2S reagerar med syre för att ge det2, som nämnts ovan (se Reaktion 3).
Den andra är en reaktion katalyserad av järnoxid där SO2 reduceras och h2S oxiderar, och de två producerar svavel (se reaktion 6).
På detta sätt erhålls svavel, som enkelt kan lagras och transporteras, samt tilldelas flera användningsområden.
Användbarhet eller betydelse av h2S endogen i organismen
H2S endogen är den som förekommer naturligt i organismen som en del av den normala metabolismen hos människor, däggdjur och andra levande varelser.
Trots sitt långvariga rykte för att vara en giftig och giftig gas förknippad med nedbrytning av organiskt material har flera nya studier från 2000 -talet till nutid fastställt att h2S endogen är en viktig regulator för vissa mekanismer och processer i levande varelse.
H2S presenterar hög lipofilicitet eller affinitet mot fetter, så det korsar enkelt cellmembran och penetrerar alla typer av celler.
Kardiovaskulära systemet
Hos däggdjur främjar eller reglerar sulfidsyra en serie signaler som reglerar metabolism, hjärtfunktion och cellöverlevnad.
Det utövar en kraftfull effekt på hjärtat, blodkärl och cirkulerande element i blod. Modulerar cellulär metabolism och mitokondriell funktion.
Försvarar njurarna om skadorna orsakade av ischemi.
Gastrointestinal system
Spela en viktig roll som en skyddande faktor mot skador på magslemhinnan. Det beräknas vara en viktig förmedlare av gastrointestinal rörlighet.
Det är troligt att det är involverat i kontrollen av insulinsekretion.
Centrala nervsystemet
Det verkar också i viktiga funktioner i centrala nervsystemet och skyddar oxidativa stressneuroner.
 Neuroner skyddas av h2S endogen. Författare: Gerd Altmann. Källa: Pixabay.
Neuroner skyddas av h2S endogen. Författare: Gerd Altmann. Källa: Pixabay. Det uppskattas att det kan skydda mot neurodegenerativa sjukdomar som Parkinsons Parkinson, Alzheimers och Hungintons sjukdom.
Synorgan
Skydda fotoreceptorceller från retinal degeneration inducerad av ljus.
Det kan tjäna dig: litiumkarbonat (Li2CO3): Struktur, egenskaper, användningarMot åldrande
H2Att vara en reducerande art kan konsumeras av en mängd oxiderande medel som cirkulerar i kroppen. Bekämpa oxiderande arter såsom reaktiva syrearter och reaktiva kvävearter i kroppen.
Begränsa reaktionerna från fria radikaler genom aktivering av antioxidantenzymer som skyddar mot åldrande effekter.
Läkande potential för h2S levereras exogent
Biotillgängligheten för h2S endogent beror på vissa enzymer involverade i biosyntesen av cystein hos däggdjur.
Vissa studier tyder på att en narkotikabehandling donor don2S kan vara fördelaktigt för vissa patologier.
Till exempel kan det vara användbart hos diabetespatienter, eftersom det har observerats att blodkärl av diabetiska djur förbättras med läkemedel som levererar H2Exogen.
H2S tillhandahöll exogent ökar angiogenes eller bildning av blodkärl, så det kan tjäna för behandling av kroniska ischemi -sjukdomar.
Läkemedel utformas som kan släppa h2S långsamt för att kunna agera förmånligt om olika sjukdomar. Emellertid måste effektiviteten, säkerheten och mekanismerna för deras handlingar fortfarande undersökas.
Risker
H2S är ett dödligt gift om det inhaleras ren eller till och med utspädd 1 del av gasen i 200 delar av luften. Fåglar är mycket känsliga för h2S och dör till och med i utspädning av 1 av 1500 delar av luften.
 Sulfidsyra eller vätesulfid h2S är ett kraftfullt gift. Författare: Openicons. Källa: Pixabay.
Sulfidsyra eller vätesulfid h2S är ett kraftfullt gift. Författare: Openicons. Källa: Pixabay. H2S är en kraftfull hämmare av vissa enzymer och oxidativa fosforyleringsprocesser, vilket leder till cell kvävning. De flesta människor uppfattar det olfitoriskt i koncentrationer större än 5 ppb (delar per miljard). Koncentrationerna av 20-50 ppm (delar per miljon) är irriterande för ögonen och luftvägarna.
En inandning av 100-250 ppm under några minuter kan generera brist på samordning, minnesstörningar och motorstörningar. När koncentrationen är cirka 150-200 ppm2S. Om en 500 ppm -koncentration inhaleras i 30 minuter kan lungödem och lunginflammation produceras.
Koncentrationer av mer än 600 ppm kan vara dödliga inom de första 30 minuterna, eftersom andningsorganen är förlamad. Och 800 ppm är den koncentration som är omedelbart dödlig för människan.
Därför bör det undvikas att det finns h -flyktingar2S i laboratorier, lokalt eller var som helst eller situation.
Det är viktigt att varna att många dödsfall inträffar eftersom människor går in i utrymmen begränsade till att rädda kollegor eller familjemedlemmar som har kollapsat på grund av förgiftning med H2S, dö dem också.
Det är en brandfarlig gas.
Referenser
- Panthi, s. et al. (2016). Fysiologisk betydelse av vätesulfid: Emerging POTNT Neuroprotector and Neuromodulator. Oxidativ medicin och cellulär livslängd. Volym 2016. Artikel ID 9049782. Hyndawi återhämtade sig.com.
- Shefa, u. et al. (2018). Antioxidant och cellsignaleringsfunktioner hos vätesulfid i centrala nervsystemet. Oxidativ medicin och cellulär livslängd. Volym 2018. Artikel ID 1873962. Hyndawi återhämtade sig.com.
- Tabassum, r. et al. (2020). Terapeutisk betydelse av vätesulfid vid åldersassocierade neurodegenerativa sjukdomar. Neural Regen Res 2020; 15: 653-662. Nrronline återhämtade sig.org.
- Martelli, a. et al. (2010). Vätesulfid: Nya möjligheter för läkemedelsupptäckt. Läkemedelsforskningsrecensioner. Volym 32, nummer 6. Hämtad från online -biblioteket.Wiley.com.
- Wang, m.-J. et al. (2010). Mekanismer för angioges: Vätesulfids roll. Klinisk och experimentell farmakologi och fysiologi (2010) 37, 764-771. Hämtad från online -biblioteket.Wiley.com.
- Dalefield, r. (2017). Rök och andra inhalerade toxikonter. Vätesulfid. I veterinär toxikologi för Australien och Nya Zeeland. Återhämtat sig från Scientedirect.com.
- Selley, R.C. och Sonnenberg, s.TILL. (2015). Petroleums fysiska och kemiska egenskaper. Vätesulfid. I delar av petroleumgeologi (tredje upplagan). Återhämtat sig från Scientedirect.com.
- Hocking, M.B. (2005). Svavelsyra. Claus Processomvandling av vätesulfid till svavel. I Handbook of Chemical Technology and Pollution Control (tredje upplagan). Återhämtat sig från Scientedirect.com.
- Lefer, D.J. (2008). Potentiell betydelse av förändringar i vätesulfid (h2S) Bioavhållbarhet vid diabetes. British Journal of Pharmacology (2008) 155, 617-619. Hämtad från BPSPUB.Onlinebibliotek.Wiley.com.
- ELLER.S. National Library of Medicine. (2019). Vätesulfid. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov.
- Port, j.TILL. och Ibarz, J. (1965). Modern allmän kemi. Sjunde upplagan. Marín redaktion, s.TILL.
- « Socialistisk utbildning ursprung, egenskaper, principer, exempel
- Neoklassisk teaterhistoria, egenskaper, representanter, verk »

