Sulfáminsyrastruktur, egenskaper, syntes, användningar
- 2020
- 219
- Anders Larsson
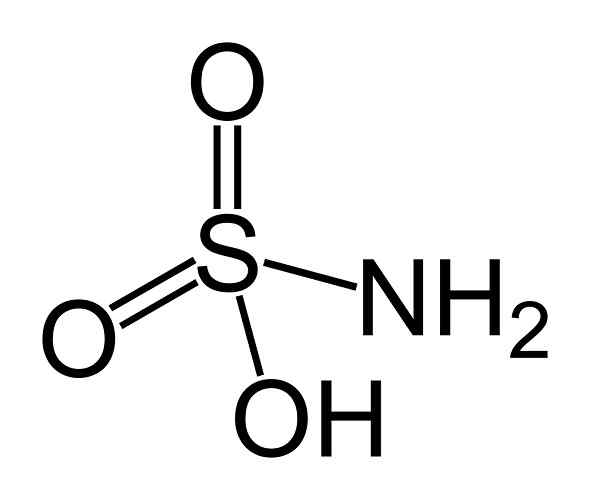
han sulfaminsyra Det är en oorganisk förening bildad av en atom av svavel (er) fäst i en kovalent form och av enkel länk till en hydroxylgrupp (-OH) och en aminogrupp (-NH2) och med dubbelbindning till två syreatomer (O). Det är ett vitt kristallint fast ämne. Dess kemiska formel är NH2Sw3H. Det är också känt som aminosulfonsyra, amidosulfonsyra, amidosulfurinsyra och sulfamidinsyra.
Sulfáminsyra är en stark syra. Du kan reagera med metaller, metall- och karbonatoxider. Salter är i allmänhet lösliga i vatten, så det är en bra remover av inlägg i processutrustning. Det används ofta i sockerbruk för att rengöra karbonatinlägg i förångare.
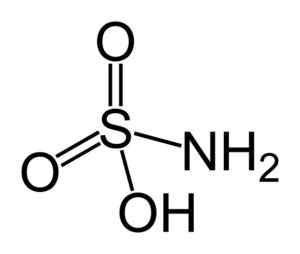 Sulfáminsyrastruktur. Benjah-Bmm27 [Public Domain]. Källa: Wikipedia Commons.
Sulfáminsyrastruktur. Benjah-Bmm27 [Public Domain]. Källa: Wikipedia Commons. Sulfáminsyra är en nitritreducerare (nej2-) och denna kemiska egenskap används i flera tillämpningar, som inom färgindustrin och nitritanalysen.
Den har användning i läderbrunnen och i blekningen av massan för pappersstillverkning. I själva verket är det en förorening av mat, eftersom det ofta finns i papper och kort som används för att packa livsmedelsbutikerna.
Det används också i metallelektrod, som ett laboratoriemönster och ett av dess derivat är en mycket effektiv herbicid.
[TOC]
Strukturera
Sulfaminsyran kristalliseras i form av bipiramidala ortorrombuskristaller. Forma kompakta prismor och ark när de kristalliseras från kall lösning, såväl som rombblad när det gör det varm vattenhaltig lösning.
Nomenklatur
- Sulfaminsyra
- Aminosulfonsyra
- Amidosulfonsyra
- Amidosulfurinsyra
- Sulfami -syra
Egenskaper
Fysiskt tillstånd
Vit kristallint fast.
Molekylvikt
97,1 g/mol.
Smältpunkt
205 ºC, sönderdelas vid 209 ºC.
Densitet
2,15 g/cm3
Löslighet
Löslig i vatten:
- 12,8% till 0 ºC
- 17,57% vid 20 ºC
- 22,77% vid 40 ° C
Knappt löslig i metanol, något löslig i aceton, olöslig i eter.
Fritt lösligt i kvävebaser och organiska lösningsmedel som innehåller kväve.
Olöslig i koldisulfid (CS2) och koltetraklorid (CCL4).
pH
0,41 (i lösning 1 n, det vill säga 1 motsvarande/l).
Dissociationskonstant
0,101 till 25 ºC.
Kemiska egenskaper
Det är en stark syra. Nästan lika mycket som saltsyror (HCl), kväve3) och svavel (h2Sw4).
Kan tjäna dig: syresatta föreningar: egenskaper, reaktioner, användningarVattenhaltiga sulfaminsyralösningar är mycket joniserade. Dess pH är lägre än lösningarna för formiva, fosfor- och oxalsyror.
I vatten förlorar sulfaminsyran bara protonen som är bunden till syre. Kväve -joinerade hydrogener förblir fast förenade.
I vattenlösning är den långsamt hydrolyserad för att ge ammoniumsyrasulfat (NH4Hso4). Är stabilt under torra förhållanden.
Sulfámic Acid Attacks Metaller, metalloxider och karbonater för att generera sulfamater. Till exempel med kaliummetall (K) kaliumsulfamat (Koso2Nh2) och väte (h2).
Alla sulfaminsyrasalter är lösliga i vatten. Kalcium-, bly- och bariumsalter är mycket lösliga i vatten, till skillnad från motsvarande svavelsyra.
Kvävesyra (HNO2) reagera kvantitativt med aminogruppen av sulfaminsyra och frisläpper kväve (N2). Det uppskattas att sulfamatjonen fungerar i denna reaktion som en amida, inte som en amin.
Sulfáminsyra oxideras av klor, brom eller kaliumklorat för att omvandla den till svavelsyra. Denna reaktion inträffar inte med andra oxidanter såsom kromsyra eller kaliumpermanganat.
Det är inte kompatibelt (reagerar) med starka alkalier, klor, hypoklorsyra, hypokloriter, cyanider och sulfider.
Andra egenskaper
Det är inte hygroskopiskt (detta betyder att det inte absorberar luftens fukt).
När den uppvärms tills sönderdelning avger mycket giftiga ångor av svaveloxider och väteklorid (HCL).
Ett av dess derivat, ammoniumsulfamat, är en brandhoppare.
Det är måttligt giftigt.
Syntes
Sulfáminsyra erhålls genom urea CO -reaktionen (NH2)2 Med rökning av svavelsyra, det vill säga svavelsyra (h2Sw4) koncentrat som innehåller svaveltrioxid (så3).
Det kan också syntetiseras genom att reagera klorosulfonsyra (HCLO3Cl) och ammoniak (NH3).
Ansökningar
I målarindustrin
Sulfáminsyra används för att ta bort överskott av nitriter snabbt och effektivt i diazotiseringsreaktioner i färgsyntes. Det är mycket mer praktiskt än urea för detta ändamål.
I läderbearbetning
Under läderbrunning ger användningen av sulfaminsyra istället för svavelsyra en tunnare och mer silkeslen struktur.
Kan tjäna dig: metallmineralerEftersom kalciumsulfamat är vattenlösligt, till skillnad från kalciumsulfat, kan sulfáminsyra användas i den avskräckta processen utan att lämna fläckar som ibland förekommer i läder när det används svavelsyra.
 Skodon. Källa: Pixabay.
Skodon. Källa: Pixabay. I rengöringsprocessutrustning
Sulfáminsyra används som en avkalkningsrengörare i kokar, reaktorer, rör, kylsystem och värmeväxlare.
I denna utrustning bildas inlägg för cirkulation av vatten eller föreningar i processen i energiväxter, kemiska anläggningar, tillvägagångssätt, pappersfabriker, kompressionsstationer och andra industrier.
Inlägg eller fasta avlagringar kan vara organiska (alger, silt, svampar) eller oorganiska (järnoxider, järnsulfider, kalcium- eller magnesiumkarbonater, sulfater, fosfater eller silikater).
Sulfáminsyra är mycket effektiv när det används för att eliminera inlagor av kalciumkarbonat. Det kan användas i kopparutrustning, mässing, rostfritt stål, gjutjärn och galvaniserat stål.
Den används i 5-10% viktlösning. Det används särskilt i sockerbruk för att rengöra förångare gjorda av gjutjärn med kopparvärmeväxlare.
 Förångarlag i ett sockerbruk. Författare: Antiksh Kumar. Källa: Pixabay
Förångarlag i ett sockerbruk. Författare: Antiksh Kumar. Källa: Pixabay Det bör användas vid temperaturer inte större än 50-60 ºC. 70 ºC -temperaturer leder till bildning av olösliga sulfater såsom fallet4.
När den används i kombination med natriumklorid inträffar en synergi -effekt och lösningen gör det möjligt för järnoxiden att långsamt lösa upp. I detta fall bör det inte användas med rostfritt stål eftersom saltsyra frigörs, vilket kan orsaka korrosion i det materialet.
I metall raffinering
Metallelektrodeposition såsom koppar, silver, kobolt, nickel, zink, kadmium, järn och bly kan framgångsrikt utföras i sulfaminsyralösningar. Detta kan hanteras mycket enklare än hydrofbar sursyra (h2Sif6).
Som ett mönsterreagens i laboratoriet
Med tanke på vissa egenskaper hos sulfaminsyran såsom: dess kraft som syra, dess enkelhet att renas genom omkristallisation i vatten, dess stabilitet och dess icke-hydroskopicitet, har den använts som en primär standard på laboratorietivå. Detta innebär att det används för kvantitativa alkalisbestämningar.
 Laboratorium. Publicdomainpictures. Källa: Pixabay
Laboratorium. Publicdomainpictures. Källa: Pixabay I nitritanalys
På grund av dess enkla reaktion med nitriter används sulfáminsyra för att bestämma dessa i lösning.
Kan tjäna dig: triklorättiksyra: struktur, egenskaper, syntes, användning, effekterI vattenanalysen upplöstes i vatten
Eftersom den reagerande sulfaminsyran med vattennitriter frigörs kväve är det möjligt att bestämma syre upplöst i vatten, eftersom störningen orsakad av nitriter elimineras.
I kväveoxidberedning
Sulfáminsyran reagerar med salpetersyrangenererande kväveoxid (N2ANTINGEN). Denna reaktion är säkrare än ammoniumnitrat för att erhålla nämnda gas.
I jordbruket
Ett sulfáminsyraderivat, ammoniumsulfamat, är en icke -toxisk herbicid för djur.
Det appliceras av dagg på arterna av de arter som ska elimineras i slutet av sommaren eller början av hösten, helst i fuktigt väder. Efter att ha flyttat föreningen från bladen till rötterna dör växten.
 Rocío Herbicid Application. Författare: Zefe Wu. Källa: Pixabay
Rocío Herbicid Application. Författare: Zefe Wu. Källa: Pixabay En annan fördel med denna förening är att marken inte steriliseras permanent. Vissa ammoniumsulfamatkväve kommer faktiskt att finnas tillgängliga på marken för växttillväxt under nästa säsong.
I brandsäkra tyger
Dess kompatibilitet med cellulosa och dess brandhämmande karakteristiska omvandlar ammoniumsulfamat till ett medel för att få brandresistenta tyger och papper.
10% av tygets vikt används, vars utseende och beröringssensation förblir oförändrad. Tyget när det används ska tvättas torrt, tvättas aldrig med vatten för att inte lösa upp till sulfamatet.
Det är användbart särskilt på teatrar eller liknande platser.
 Teater. Författare: Mustangjoe Källa: Pixabay
Teater. Författare: Mustangjoe Källa: Pixabay I olika applikationer
Det används som en katalysator i vissa kemiska reaktioner, som i beredningen av urea-formalde hartser. Det är också användbart som baktericid och stabilisator av klor i simbassänger och som en trämassablekmedel i massa och pappersfabriker.
Referenser
- ELLER.S. National Library of Medicine. (2019). Sulfaminsyra. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov
- Williams, D.L.H. (2004) Nitrosation vid kvävecenter. I nitrosationsreaktioner och kemi för kväveoxid. kapitel 2. Återhämtat sig från Scientedirect.com
- Clapp, Leallyn B. (1943). Sulfaminsyra och dess användning. Kem. Utbildare. 1943, 20, 4, 189. Återhämtat sig från pubar.ACS.org
- McDonald, James. (2003). Sulfaminsyra. Återhämtat sig från Veoliawatertech.com
- Sastri, v.S. (2010). Hantering och kontroll av korrosion. I Shreirs korrosion. Återhämtat sig från Scientedirect.com
- Bajpai pratima. (2018). Diverse ämnen. I Biermanns handbok av massa och papper. Tredje upplagan. Återhämtat sig från Scientedirect.com

