Yodhydronsyra (HI) struktur, egenskaper och användningar

- 4093
- 202
- PhD. Emil Svensson
han iarhydronsyra Det är en vattenlösning av vätejodid som kännetecknas av dess höga surhet. En definition som är mer knuten till den kemiska terminologin och IUPAC, är att det är en hydracy, vars kemiska formel är hej.
För att skilja det från de gasformiga molekylerna i vätejodid, HI (g), betecknas det dock som HI (AC). Det är av detta skäl som i kemiska ekvationer är det viktigt att identifiera miljön eller fysiska fasen där reagens och produkter har varit. Trots detta är förvirringar mellan vätejodid och iarklorsyra vanligtvis vanliga.
 Iarhydronsyrajoner. Källa: Gabriel Bolívar.
Iarhydronsyrajoner. Källa: Gabriel Bolívar. Om de engagerade molekylerna observeras i deras identitet kommer ökända skillnader mellan HI (G) och HI (AC) att hittas. I HI (G) finns det en H-I-länk; Medan de är i HI (AC) är de faktiskt ett par joner i- och h3ANTINGEN+ interagerande elektrostátiskt (överlägsen bild).
Å andra sidan är HI (AC) en källa till HI (g), eftersom den första framställs genom upplösningen av den andra i vatten. På grund av detta, såvida det inte är i en kemisk ekvation, kan HI också användas för att också hänvisa till Iarchydric Acid. HI är ett starkt reducerande medel och en utmärkt källa till joner i- I vattenhaltigt medium.
[TOC]
Jodhydronsyrastruktur
Yodhydronsyra, som förklarats, består av en lösning av HI i vatten. När han är i vattnet dissocierar Hi -molekyler helt (stark elektrolyt) och har sitt ursprung i jonerna i- och h3ANTINGEN+. Denna dissociation kan representeras med följande kemiska ekvation:
Hej (g) + h2Eller (l) => i-(Ac) + h3ANTINGEN+(Ac)
Vad skulle vara motsvarande om det är skrivet som:
Hej (g) + h2Eller (l) => hej (ac)
HI (AC) avslöjar emellertid inte alls vad som har hänt med de gasformiga HI -molekylerna; Det indikerar bara att de är i vattenhaltigt medium.
Därför består den verkliga strukturen hos HI (AC) av joner i- och h3ANTINGEN+ omgiven av vattenmolekyler som fuktar dem; Ju mer koncentrerad iarhydrric -syran, desto lägre är antalet vattenmolekyler utan proton.
Kan tjäna dig: Boyle LawKommersiellt är HI -koncentrationen i själva verket 48 till 57% i vatten; Mer koncentrerad skulle motsvara att ha en syra för rökning (och ännu farligare).
På bilden kan man se att anjon i- Det representeras med en lila sfär och h3ANTINGEN+ Med vita sfärer och en röd, för syreatom. Katjonen h3ANTINGEN+ Presenterar molekylär geometri trigonal pyramid (sett från ett högre plan i bilden).
Egenskaper
Fysisk beskrivning
Färglös vätska; Men du kan ställa ut gulaktiga och bruna toner om du är i direktkontakt med syre. Detta beror på att joner i- De slutar oxidera molekyljod, i2. Om det finns mycket jag2, Det är mer än troligt att triaduroanjonen kommer att bildas, jag3-, som fläckar lösningen som brun.
Molekylär massa
127,91 g/mol.
Lukt
Tunnland.
Densitet
Densiteten är 1,70 g/ml för 57%HI -lösningen; Sedan varierar tätheter beroende på de olika koncentrationerna av HI. Denna koncentration bildar en azeotropisk (den destilleras som ett enda ämne och inte som en blandning) vars relativa stabilitet kan vara skyldig sin kommersialisering ovanför andra lösningar.
Kokpunkt
57% HI Azeotrope kokar vid 127 ° C vid ett tryck på 1,03 bar (pass till ATM).
Pka
-1,78.
Aciditet
Det är en extremt stark syra, så mycket att den är frätande för alla metaller och vävnader; Även för gummi.
Detta beror på att H-I-länken är mycket svag och lätt bryts under dess vattenjonisering. Dessutom vätebroar i- - Hoh2+ De är svaga, så det finns inget att störa h3ANTINGEN+ reagera med andra föreningar; det vill säga h3ANTINGEN+ har "gratis", som i- Det lockar inte för mycket till hans motion.
Kan tjäna dig: pycnometerReduktionsmedel
HI är ett kraftfullt reducerande medel, vars huvudreaktionsprodukt är jag2.
Nomenklatur
Nomenklaturen för iarhydronsyra härrör från det faktum att joden "fungerar" med ett enda oxidationstillstånd: -1. Och dessutom indikerar namnet att det har vatten inom dess strukturella formel [i-] [H3ANTINGEN+]. Detta är dess enda namn, eftersom det inte är en ren förening utan en lösning.
Ansökningar
Jodkälla i organisk och oorganisk syntes
HI är en utmärkt källa till joner i- för oorganisk och organisk syntes och är också ett kraftfullt reducerande medel. Till exempel används dess 57% vattenhaltiga upplösning för syntes av alkyljodider (som CHO3Ch2I) från primära alkoholer. På samma sätt kan en OH -grupp ersätta i en struktur av en i.
Reduktionsmedel
Yodhydronsyra har använts för att till exempel minska kolhydrater. Om glukos upplöst i denna syra värms kommer den att förlora alla sina OH-grupper, vilket får som en produkt n-hexanhydrokaron.
På samma sätt har det använts för att minska funktionella grupper av grafenark, så att de kan funktionaliseras för elektroniska enheter.
Cativa -process
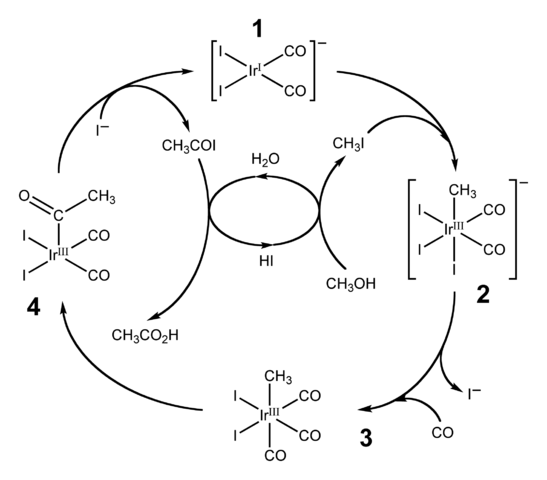 Diagram över den katalytiska cykeln för cativa -processen. Källa: Ben Mills [Public Domain Domain].HI används också för industriell produktion av ättiksyra genom Cativa -processen. Detta består av en katalytisk cykel i vilken metanol -karbonilering inträffar; det vill säga till molekylen i CH3Åh en karbonylgrupp introduceras, C = O, för att förvandlas till Cho -syra3Cooh.
Diagram över den katalytiska cykeln för cativa -processen. Källa: Ben Mills [Public Domain Domain].HI används också för industriell produktion av ättiksyra genom Cativa -processen. Detta består av en katalytisk cykel i vilken metanol -karbonilering inträffar; det vill säga till molekylen i CH3Åh en karbonylgrupp introduceras, C = O, för att förvandlas till Cho -syra3Cooh.
Steg
Processen börjar (1) med organo-iridiumkomplexet [IR (CO)2Yo2]-, av fyrkantig platt geometri. Denna förening "tar emot" metyljodiden, CH3Jag, produkt av CHO -surgöring3Åh med 57% hej. Vatten förekommer också i denna reaktion, och tack vare den erhålls ättiksyra i slutet, samtidigt som Hi kan återhämta sig i det sista steget.
Kan tjäna dig: kolloidI detta steg båda gruppen -ch3 Som -Jag går med i ididio metallcentret (2) och bildar ett oktaedralt komplex med en fasett sammansatt av tre ligander och. En av Yodos slutar med att ersätta sig med en kolmonoxidmolekyl, CO; Och nu (3) har det oktaedriska komplexet en fasett som består av tre co -ligander.
Då inträffar en omarrangemang: -ch -gruppen3 Det är "släppt" från IR och går med i det intilliggande (4) för att bilda en acetylgrupp, -Coch3. Denna grupp släpps från Iridido -komplexet för att länka till jodjonerna och ge CHO3COI, acetyljodid. Här återvinns iridiumkatalysatorn, redo att delta i en annan katalytisk cykel.
Slutligen Cho3COI lider av en ersättning av i- För en H -molekyl2Eller vars mekanism slutar med att släppa hej och ättiksyra.
Olaglig syntes
 Efedrinreduktionsreaktion med röd fosfor och fosfor till metafetamin. Källa: metamfetamine_from_ephedrine_with_hi_ru.SVG: Derived Ring0 Trabajo: MaterialScientist (talar) [Public Domain].Yodhydronsyra har använts för syntes av psykotropiska substanser som drar nytta av dess höga reduktiva kraft. Till exempel kan du minska efedrin (en medicin för astmabehandling) i närvaro av röd fosfor, till metamfetamin (överlägsen bild).
Efedrinreduktionsreaktion med röd fosfor och fosfor till metafetamin. Källa: metamfetamine_from_ephedrine_with_hi_ru.SVG: Derived Ring0 Trabajo: MaterialScientist (talar) [Public Domain].Yodhydronsyra har använts för syntes av psykotropiska substanser som drar nytta av dess höga reduktiva kraft. Till exempel kan du minska efedrin (en medicin för astmabehandling) i närvaro av röd fosfor, till metamfetamin (överlägsen bild).
Det kan ses att en ersättning av OH -gruppen av i, följt av en andra ersättning för en h.
Referenser
- Wikipedia. (2019). Hydroiodsyra. Hämtad från: i.Wikipedia.org
- Andrews, Natalie. (24 april 2017). Användningen av hydriodsyra. Forskning. Återhämtat sig från: forskning.com
- Alfa Aesar, Thermo Fisher Scientific. (2019). Hydriodinsyra. Återhämtat sig från: alfa.com
- Nationellt centrum för bioteknikinformation. (2019). Hydriodinsyra. Pubchemdatabas., CID = 24841. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Steven a. Botekar. (2017). Illustrerad ordlista för organisk kemi: hydroiodinsyra. Återhämtad från: kem.Ucla.Edu
- Reusch William. (5 maj 2013). Kolhydrater. Återhämtad från: 2.Kemi.Msu.Edu
- I Kyu Moon, Junghyun Lee, Rodney S. Ruoff & Hyoyoung Lee. (2010). Rödad traphenoxid genom kemisk grafitisering. Doi: 10.1038/NCOMMS1067.
- « Memoristiska inlärningsegenskaper, typer och exempel
- Bioprocessernas egenskaper, typer, fördelar och stadier »

