Cysteinegenskaper, struktur, funktioner, biosyntes
- 3956
- 22
- Erik Eriksson
De Cystein (Cys, c) är en av de 22 aminosyrorna som finns i naturen som en del av polypeptidkedjorna som utgör proteinerna från levande varelser. Det är viktigt för stabiliteten hos de tertiära strukturerna hos proteiner, eftersom det hjälper bildandet av intramolekylära disulfidbroar.
Liksom det är sant för andra aminosyror som alanin, arginin, asparagin, glutamat och glutamin, glycin, prolin, serin och tyrosin, människor kan syntetisera cystein, så detta betraktas inte som en essentiell aminosyra.
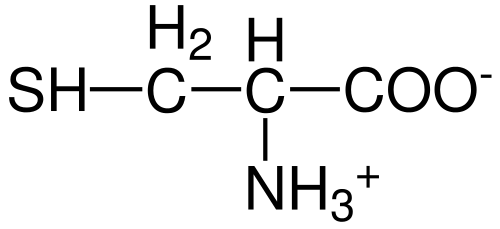
 Cysteine aminosyrastruktur (källa: Hattrich [allmän domän] via Wikimedia Commons)
Cysteine aminosyrastruktur (källa: Hattrich [allmän domän] via Wikimedia Commons) Trots detta, och med tanke på att syntesfrekvensen inte alltid levererar kroppskrav, beskriver vissa författare cystein som en "villkorligt" i huvudsak "aminosyra.
Denna aminosyran namngavs av "cystina", en del av de vesikulära beräkningarna som upptäcktes 1810, vars namn myntades 1832 av en. Baudrimont och f. Malaguti. Några år senare, 1884, och. Baumann upptäckte att cystein var produkten av cystinreduktion.
Efter det arbete som gjorts av Bauman, 1899, fastställdes att cystein är den viktigaste beståndsdelen av proteinet som bildar hornen hos olika djur, vilket antydde att det är möjligt användning för polypeptidsyntes.
För närvarande är det känt att kroppscystein kommer från mat, proteinåtervinning och endogen syntes, som huvudsakligen förekommer i hepatocyter.
[TOC]
Egenskaper
Cystein har en molekylvikt på 121.16 g/mol och hittas tillsammans med leucin, isoleucin, valin, fenylalanin, tryptofan, metionin och tyrosin, bland de mest hydrofoba aminosyrorna.
Det tillhör gruppen av polära aminosyror utan belastning och, som andra aminosyror, kan den försämras genom alkalisk hydrolys vid höga temperaturer.
Liksom tryptofan, serin, glycin och treonin, är cystein en metabolisk föregångare för glukoneogenes och ketogenes (bildning av ketonkroppar).
Denna aminosyra finns som en del av peptidsekvensen av proteiner, men kan också vara fri i blodplasma som homogena disulfider (cystin, ett derivat) eller blandat, sammansatt av homocystein-cysteinformen.
Den största skillnaden mellan fri cystein och den som finns i proteinstrukturen är att den första är i ett mycket rostigt redoxtillstånd, medan den sista vanligtvis är ganska reducerad.
Strukturera
Liksom med resten av de beskrivna aminosyrorna hittills har cystein en central kolatom, som är chiral och kallas kol a.
Fyra olika kemiska arter förenas med denna kolatom:
- En aminogrupp (-NH3+)
- En karboxylgrupp (-CO-)
- en väteatom och
- En substituent (-r).
Substituent -gruppen är den som ger identitet till varje aminosyra och cysteinens kännetecken kännetecknas av att innehålla en svavelatom som en del av en grupp Tiol antingen Sulfhydrillo (-Ch2-sh).

Det är denna grupp som tillåter den att delta i bildandet av intra-interminolekylära disulfidbroar. Eftersom det är en nukleofil kan du också delta i substitutionsreaktioner.
I själva verket kan denna sidokedja av cystein modifieras för bildning av två föreningar som kallas "Selenocysteine" och "Lantionine". Den första är en aminosyra som också deltar i proteinbildning och den andra är ett icke -protein aminosyrorivat.
Kan tjäna dig: Histoner: Egenskaper, struktur, typer och funktionerCysteine Tiol -gruppen kännetecknas också av dess stora affinitet till silver- och kvicksilverjoner (Ag+ och Hg2+).
Funktioner
Cysteinens huvudfunktioner i levande organismer har att göra med deras deltagande i proteinbildning. Specifikt deltar cystein i upprättandet av disulfidbroar, som är viktiga för bildandet av tertiär proteinstruktur.
Dessutom är denna aminosyran inte bara användbar för proteinsyntes, utan deltar också i syntesen av glutation (GSH) och ger reducerat svavel för metionin, lipoinsyra, tiamin, koenzym A (COA), molybdopterin (en kofaktor) och annan Föreningar med biologisk betydelse.
Under förhållanden med överdriven mängd svaveliserade aminosyror kan cystein och andra relaterade aminosyror användas för produktion av oorganisk pyruvat och svavel. Pyruvate lyckas omdirigeras mot den glukoneogena vägen och tjänar för glukosproduktion.
Keratinerna, som är en av de vanligaste typerna av strukturella proteiner i djurriket, är rika på cysteinrester. Till exempel innehåller fårull mer än 4% svavel från denna aminosyra.
Cystein deltar också i många oxidreduktionsreaktioner, så det är en del av den aktiva platsen för vissa enzymer.
När man reagerar med glukos genererar denna aminosyran reaktionsprodukter som introducerar attraktiva smaker och aromer till vissa kulinariska preparat.
Biosyntes
Biosyntesen av aminosyror i människokroppen och hos andra djur (däggdjur och icke-däggdjur) äger rum i en vävnadsform och cellklass; Det är en process som förtjänar energi och separeras vanligtvis mellan olika organ.
Levern är ett av de viktigaste organen som är involverade i syntesen av de flesta icke -essentiella aminosyror, oavsett de arter som beaktas.
I detta syntetiseras inte bara cysteinet, utan också aspartat, asparagin, glutamat och glutamin, glycin, serin, tyrosin och andra från dess specifika aminosyror föregångare.
1935 bestämde Erwin -varumärket att cystein, hos däggdjur, är naturligt syntetiserad från metionin, som uteslutande äger rum i levervävnad.
Denna process kan uppstå på grund av en "transmetil" metionin, där metylgrupper överförs till kulle och kreatin. Cystein kan emellertid också bildas från metionin tack vare en transulfuration.
Därefter demonstrerades det att utöver mätning är vissa syntetiska föreningar såsom N-acetylcystein, cysteamin och cystamin användbara föregångare för cysteinsyntes.
När det gäller N-acetylcysteinet tas detta av cellerna, där det omvandlas till cystein av ett enzym av cytosolen i cytosolen.
Syntesmekanism
Mekanismen för syntes av cystein från den mest kända metoden är den för trans -ululo. Detta inträffar främst i levern, men det har också fastställts i tarmen och bukspottkörteln.
Detta inträffar från homocystein, en förening härrörande från aminosyrametod; Och den första reaktionen av denna biosyntetiska väg är en kondensation som katalyseras av ß-sentas (CBS) cistationinenzym (CBS).
Kan tjäna dig: uracil: struktur, funktioner, egenskaper, syntesDetta enzym representerar passagen av "engagemang" av rutten och kondenserar en homocystein med en serinrest, en annan proteinaminosyra, som producerar cystationin. Därefter är denna förening "klippt" eller "delad" av cistationasa -enzymet, vilket leder till frisläppandet av cystein.
Regleringen av CBS -enzymatisk aktivitet förmedlas av tillgängligheten av metodin och av redoxtillståndet i cellen där denna process inträffar.
Genom cysteinsyntesvägen kan celler hantera överskottsmetod, eftersom deras omvandling till cystein är en irreversibel process.
Cysteinsyntes i växter och mikroorganismer
I dessa organismer syntetiseras cysteinet huvudsakligen från oorganiskt svavel, som är den vanligaste källan till användbar svavel i den aeroba biosfären.
Detta tas, kommer in i cellerna och reduceras sedan till sulfid (S2-), som är införlivad i cysteinet på liknande sätt som vad som händer med ammonium i syntesen av glutamat eller glutamin.
Metabolism och nedbrytning
Katabolism cystein förekommer huvudsakligen i leverceller (hepatocyter), även om det också kan förekomma i andra typer av celler såsom neuroner, endotelceller och glatta muskelceller i kroppsvaskulaturen.
Vissa defekter i katabolismen hos cystein producerar en ärftlig sjukdom känd som "cystinuri", kännetecknad av närvaron av cystinberäkningar i njurarna, urinblåsan och urinledaren.
Cystinet är en aminosyran härrörande från cysteinen och beräkningarna bildas av föreningen av två molekyler genom deras svavelatomer.
En del av metabolismen av cystein resulterar i bildning av vetenskaplig syra, från vilken tjurfäktning, en icke-proteisk aminosyra bildas. Reaktionen katalyseras av dioxigenasa -cysteinenzymet.
Dessutom kan cysteinet oxideras av formaldehyden för att producera N-formil cystein, vars efterföljande bearbetning kan leda till bildandet av ”varor” (produkt av kondensation av cysteiner med aromatiska föreningar).
Hos djur används cystein också, såväl som glutamat och glutamin, för syntes av koenzym A, glutation (GSH), pyruvat, sulfat och sulfiderinsyra.
En av metoderna för omvandling från cystein till pyruvat sker i två steg: den första innebär avlägsnande av svavelatomen och den andra en transaminationsreaktion.
Njurarna är ansvariga för utsöndring av sulfater och sulfiter härrörande från metabolismen av svavelföreningar såsom cystein, medan lungorna andas ut svaveldioxid och sulfidryra.
Glutation
Glutation, en molekyl som bildas av tre aminosyravfall (glycin, glutamat och cystein) är en molekyl som finns i växter, djur och bakterier.
Den har speciella egenskaper som gör det till en utmärkt redox "buffert", eftersom den skyddar celler från olika typer av oxidativ stress.
Livsmedel rika på cystein
Cystein finns naturligtvis i livsmedel som innehåller svavel som äggulorna (gula) av ägg, röda paprika, vitlök, lök, broccoli, blomkål, kolliflower, kollils och brysselkolar, vattenklakor och senapsblad.
Det finns också mestadels i protein -rika livsmedel som kött, baljväxter och mejeriprodukter, bland vilka är:
Kan tjäna dig: ovalbumin: struktur, funktioner, denaturering- Ko kött, fläsk, kyckling och fisk
- Havre och linser
- Solrosfrön
- Yoghurt och ost
Fördelar med cysteinintag
Det anses att dess intag förhindrar håravfall och stimulerar dess tillväxt. I livsmedelsindustrin används det mycket som panifierbart massagemedlat och också för att "reproducera" de köttliknande smakerna.
Andra författare har betonat att intaget av kosttillskott eller mat -rika livsmedel minskar.
Vissa näringstillskott relaterade till cystein används av människor som antioxidanter, vilket anses vara fördelaktigt från synvinkeln för "förseningen" av åldrande.
N-acetylcysteinet (en föregångare i syntesen av cysteinet) tas till exempel som ett näringstillskott, eftersom detta resulterar i en ökning av glutationbiosyntesen (GSH).
Relaterade sjukdomar
Det finns några vetenskapliga publikationer som relaterar höga nivåer av plasmakystein med fetma och andra relaterade patologier som hjärt -kärlsjukdomar och andra metaboliska syndrom.
Cystinuria, som nämnts ovan, är en patologi som är relaterad till närvaron av cystinstenar, ett zip -derivat på grund av en genetisk defekt i reabsorptionen av de dibasiska aminosyrorna såsom cystin.
Brist
Cysteinbrist har varit relaterat till oxidativ stress, eftersom detta är en av de viktigaste föregångarna för glutation syntes. Därför kan brister i denna aminosyran leda till för tidigt åldrande och alla lägenheter som detta betyder.
Det har visats experimentellt att cysteintillskott förbättrar skelettmuskelns funktioner, minskar förhållandet mellan fett och icke -fettkroppsmassa, minskar plasmanivåerna av inflammatoriska cytokiner, förbättrar immunsystemets funktioner etc.
I mitten av -1990 -talet antydde vissa studier att förvärvad immunbrist (AIDS) -syndrom kan vara en följd av en virusinducerad cysteinbrist.
Dessa uttalanden stöds av det faktum att hi-positiva patienter undersökte hade låga nivåer av plasmacystin och cystein, utöver minskade intracellulära koncentrationer av glutation.
Referenser
- Dröge, w. (1993). Cystein- och glutationbrister hos AIDS-patienter: En grund för behandling med N-Aceicyl-Cysteine. Farmakologi, 46, 61-65.
- Dröge, w. (2005). Oxidativ stress och åldrande: åldras ett cysteinbristsyndrom? Filosofiska transaktioner från Royal Society B: Biologiska vetenskaper, 360(1464), 2355-2372.
- Elshorbagy, a. K., Smith, A. D., Kozich, V., & Refsum, h. (2011). Cystein och fetma. Fetma, tjugo(3), 1-9.
- Kridich, n. (2013). Biosyntes av cystein. Ecosal plus, 1-30.
- McPherson, R. TILL., & Hardy, g. (2011). Kliniska och näringsmässiga fördelar med cysteinberikade proteintillskott. Aktuell åsikt i klinisk näring och metabolisk vård, 14, 562-568.
- Mokhtari, V., Afsharian, s., Shahhoseini, m., Kalantar, s. M., & Moini, a. (2017). En översyn av olika användningar av N-acetylcystein. Celldagbok, 19(1), 11-17.
- Pist, s. (2013). Cystein-master-antioxidant. International Journal of Pharmaceutical, Chemical and Biologic Sciences, 3(1), 143-149.
- Quig, D. (1998). Cysteinmetabolism och metalloxicitet. Alternativ medicinöversikt, 3(4), 262-270.
- Wu, g. (2013). Amininsyror. Biokemi och näring. Boca Raton, FL: Taylor & Francis Group.
- « Sociala inlärningsegenskaper, bandura -teori, exempel
- Socio -emotionella utbildningsdimensioner, betydelse, förskola »

