Aluminiumklorid (ALCL3)

- 4099
- 1154
- Johan Olsson
 Formel och struktur av aluminiumklorid
Formel och struktur av aluminiumklorid Vad är aluminiumklorid?
han aluminiumklorid Det är en oorganisk kemisk förening vars formel är alcl3. Det presenteras som ett fast eller vitt damm, även om det på grund av en förorening med järnklorid och fukt kan bli gul. Den består av en Lewis -syra, men under vissa omständigheter uppträder det också som en Lewis -bas.
Trots aluminium som en metall i periodisk tabell finns det en kovalent bindning mellan aluminium och klor för att bilda aluminiumklorid.
Denna kovalenta bindning kan förklara varför smält aluminiumklorid är en dålig elektricitetsledare; Medan de smälta salterna från andra föreningar, såsom natriumklorid, är goda elektricitetsledare.
Aluminiumklorid produceras genom en exoterm reaktion mellan aluminium och klor eller väteklorid vid en temperatur mellan 650 och 750 ºC.
Aluminiumklorid används som en antitranspirant och för att bekämpa överdriven svettning. Ett av dess derivat används som koagulantmedel vid behandling av industriellt avloppsvatten och används också som huvudkatalysator i branschens kemiska reaktioner.
Aluminiumkloridstruktur
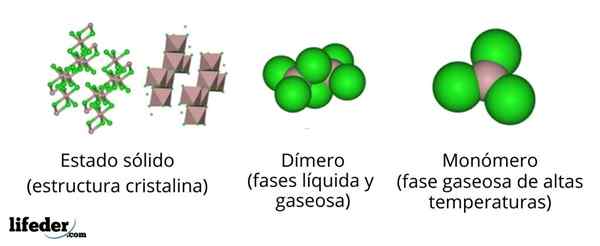
I den övre bilden har vi olika representationer för var och en av de kristallina eller molekylära strukturerna som uppvisar den vattenfria aluminiumkloriden, ALCL3, I flera av hans fysiska tillstånd.
Alcl3 Fast fast består av en monoklinisk kristallin struktur som bildas av lager av octaedros samordnade med varandra. I dessa oktaedra (brun färg), jonen till3+ Det är koordinerat med sex Cl -joner-, Agerar klorider som broar mellan två oktaedra.
När temperaturen ökar och Alll är grundad3, Skikten är uppdelade i enheter till2Kli6 (Bildcenter). Nu bildar aluminiumatomen kopplingar till tre kloratomer och en koppling till den andra aluminiumatomen: CL3Al -alcl3. Dessa dimerer förklarar varför ALCL3 Molten är mindre tät än dess kristaller.
Kan tjäna dig: gadolinio: struktur, egenskaper, erhållning, användningI ångfasen2Kli6 De distanserar varandra. Men om denna ånga utsätts för höga temperaturer, dissocierar dimeren i molekylenheter ALCL3, där aluminiumatomen bildar tre länkar med kloratomer. Alcl3 presenterar en trigonal platt geometri.
Aluminiumkloridegenskaper
 Fast prov av aluminiumklorid med gulaktiga toner. Källa: Xlollitox, CC av 3.0, via Wikimedia Commons
Fast prov av aluminiumklorid med gulaktiga toner. Källa: Xlollitox, CC av 3.0, via Wikimedia Commons Formler
Alcl3 (vattenfri)
Alcl3· 6h2O (hexahydrat)
Molmassa
133.34 g/mol (anhydro)
241.43 g/mol (hexahydrat)
Fysiskt utseende
Kristallint fast eller vitt damm. Det kan bli en gulaktig nyans på grund av förorening med järnklorid. Du kan också byta till en gråaktig färg för fukt.
Smältpunkt
192.4 ºC
Kokpunkt
Sublima vid 178 ºC, så det är inte lätt att få kokpunkten för aluminiumklorid.
Densitet
2.48 g/cm3 (vattenfri)
2.398 g/cm3 (Hexahydrat)
Vattenlöslighet
439 G/L A 0 ºC
458 g/L vid 20 ºC
466 g/l a 30 ºC
Aluminiumklorid är en hygroskopisk förening som kan absorbera vått luftvatten och avge en rök under processen.
Löslighet i andra lösningsmedel
Etanollöslig, kloroform, koltetraklorid, bensofenon och nitrobensen. Något lösligt i bensen.
Ångtryck
13.3 kPa vid 151 ºC (0.131 atm).
Gegga
0.35 CP till 197 ºC
Reaktivitet
Aluminiumklorid är ett amfotatämne, det vill säga det uppför sig som en syra eller en bas. Emellertid är dess verkan som en syra övervägande, eftersom aluminiumklorid används som en Lewis -syra och samtidigt är en katalysator i många kemiska reaktioner; Bland dem, Friedel-hantverks reaktion.
Kan tjäna dig: Neodymium: Struktur, egenskaper, användningarTill och med aluminiumklorid klassificeras som en syra, istället för att göra det som ett salt.
Vattenfri aluminiumklorid i vattenhaltig lösning omvandlas till hexahydratsalt (ALCL3· 6h2O), som inte återgår till den vattenfria formen genom att värma.
Aluminiumatomer av två ALCL -molekyler3 De interagerar med varandra för att slutföra 8 elektroner i sitt valensskikt, vilket resulterar i bildningen av dimeren till2Kli6. Denna dimer finns i smält aluminiumklorid och ånga.
Aluminiumklorid reagerar med natriumhydroxid för att bilda aluminiumhydroxid, en gelatinös fällning:
Alcl3 + NaOH → AL (OH)3 + 3 NaCl
Aluminiumkloridapplikationer
Antitranspirant och antihemorragisk
 Aluminiumklorid är en del av ingredienserna som används i formuleringarna av flera deodoranter. Källa: Th145, CC BY-SA 2.0, via Wikimedia Commons
Aluminiumklorid är en del av ingredienserna som används i formuleringarna av flera deodoranter. Källa: Th145, CC BY-SA 2.0, via Wikimedia Commons Aluminiumklorid används som en antitranspirant hos personliga deodoranter och används också för att kontrollera överdriven svettning (hyperhidros). Det används också i formuleringar för att kontrollera små blödningar, till exempel de som presenteras i tandbehandlingar.
Avloppsrening
Aluminiumklorid i form av PAC (polyaluminklorid) används som koagulant vid behandling av industriellt avloppsvatten på grund av dess förmåga att klargöra vatten och dehydratslam.
Katalysator
Aluminiumklorid är en av de viktigaste katalysatorerna som används i branschen och fungerar som en katalysator i många reaktioner, inklusive Friedel-hantverk.
Kan tjäna dig: Europium: Struktur, egenskaper, erhållning, användningAluminiumklorid katalyserar beredningsreaktionerna från antakinoner, av vilka några används inom textilindustrin. Det finns också antakinoner som har antibakteriella, antiparasitiska, fungicidala och antivirala egenskaper.
Aluminiumklorid katalyserar reaktionerna som produceras av dodecilbensen, som används vid produktion av tvättmedel och etylbensen, förening som används vid tillverkning av polystyren, polymer som används vid utarbetande av plast, hartser och gummi.
Aluminiumklorid används också som en katalysator i en reaktion som är en del av bensinproduktionen med hög oktan. På samma sätt katalyserar oljesprickprocessen.
Risker
Aluminiumklorid är ett frätande ämne och dess kontakt kan orsaka irritation och hud- och ögonskador, vilket ger ögonskador.
Vid upplösning i vattnet kan giftiga gaser frisättas, såsom väteklorid; Gaser som kan andas in en irritation i näsan och halsen, att kunna orsaka tuff och lungirritation. Denna irritation kan leda till ackumulering av vätska i lungorna (lungödem), som slutar i en medicinsk nödsituation.
Den har försökt upprätta en koppling mellan Alzheimers sjukdom och aluminiumklorid; Även om forskningsresultaten inte är avgörande.
På samma sätt har sambandet mellan användningen av deodoranter som de använder som anti -transpirant till Alll undersökts3 och bröstcancer. Forskning har inte kunnat visa en avgörande relation. I vilket fall som helst blockerar aluminiumklorid driften av ett naturligt avgiftningssystem för organismen och värmeutsläpp, såsom svett.
Referenser
- Wikipedia. (2021). Kloridaluminium. Hämtad från: i.Wikipedia.org
- National Center for Biotechnology Information (2021). Klorid aluminium, pubchem compound sammanfattning för CID 24012. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- NJ Health. (2008). Faktablad för farligt ämne: aluminiumklorid. [Pdf]. Återhämtat sig från: nj.Gov
- Britannica Encyclopaedia. (2021). Kloridaluminium. Återhämtat sig från: Britannica.com
- Elsevier b.V. (2021). Antakinoner. Vetenskaplig. Hämtad från: Scientedirect.com
- John P. Cunha. (02 maj 2020). Aktuell kloridaluminium. Återhämtat sig från: rxlist.com

