Järnklorid (iii) struktur, egenskaper, erhållning, användning
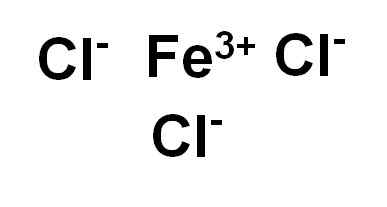
- 738
- 40
- Karl Johansson
han Järnklorid (III) Det är en oorganisk förening som bildas av järn (tro) och klorelement (CL). Dess kemiska formel är FECL3. Det är ett kristallint fast ämne vars färg kan vara från orange till svartbrun.
Fecl3 Det upplöses lätt i vatten som bildar sura vattenlösningar där genom att öka pH som gör dem mer alkaliska.
 Järnklorid (III) eller järnklorid FECL3 fast. Еор märke.Org/licenser/BY-SA/3.0). Källa: Wikimedia Commons.
Järnklorid (III) eller järnklorid FECL3 fast. Еор märke.Org/licenser/BY-SA/3.0). Källa: Wikimedia Commons. Järnklorid (III) används för att sedimentera partiklarna som förorenar kommunalt eller industriellt avloppsvatten. Det sägs att det gör att du kan ta bort vissa parasiter och tjäna till att stoppa blodförluster från djur i djur och för läkning av dessa.
Det tjänar till att extrahera koppar (ii) av kopparsulfidmineraler. Det används också i olika kemiska reaktioner och analys av biologiska och kemiska laboratorier. Till exempel tjänar det till att upptäcka föreningar som fenoler i oljor extraherade från växter. Det används i elektroniska kretsar, i läderbanan och i fotografering.
För att vara FECL3 En syraförening är frätande för hud- och slemhinnor. Dammet från denna förening måste undvikas. Det bör inte kasseras för miljön.
[TOC]
Strukturera
Järnklorid (III) eller järnklorid FECL3 Det är en jonisk förening och bildas av en järntrob3+ och tre joner klorid Cl-. Järn är i sitt oxidationstillstånd +3 och varje klor har Valencia -1.
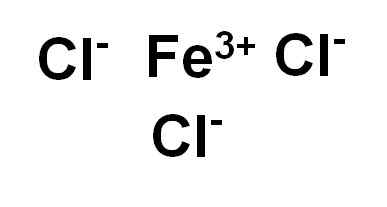 Järnklorid (III) eller järnklorid. Författare: Marilú Stea.
Järnklorid (III) eller järnklorid. Författare: Marilú Stea. Nomenklatur
- Järnklorid (III)
- Järnklorid
- Järntriklorid
- Järnmuriatyr
Egenskaper
Fysiskt tillstånd
Kristallin fast orange till svartbrun.
 Järnklorid FECL3 vattenfri (utan vatten). Leiem/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/4.0). Källa: Wikimedia Commons.
Järnklorid FECL3 vattenfri (utan vatten). Leiem/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/4.0). Källa: Wikimedia Commons. Molekylvikt
Anhidro fecl3 = 162,2 g/mol
Smältpunkt
Anhidro fecl3 = 304 ºC
Hexahydrat FECL3 •6h2O = 37 ° C
Kokpunkt
Anhidro fecl3 = Ungefär 316 ºC
Hexahydrat FECL3 •6h2O = 280-285 ° C
Densitet
Anhidro fecl3 = 2,90 g/cm3 vid 25 ° C
Löslighet
Mycket lösligt i vatten: 74,4 g/100 g vatten vid 0 ° C; 535,7 g/100 g vatten vid 100 ° C. Mycket löslig i aceton, etanol, eter och metanol. Svagt lösligt i icke -polära lösningsmedel som bensen och hexan.
Kan tjäna dig: Bor: historia, egenskaper, struktur, användningarpH
Dess vattenhaltiga lösningar är mycket sura. En lösning av 0,1 mol FECL3 per liter vatten har ett pH på 2,0.
Kemiska egenskaper
När fadl upplöses i vatten3 Den är hydrolyserad; det vill säga det skiljer sig i sina trojoner3+ och 3 cl-. Tro3+ bilda hexaacuohierrojonen [tro (h2ANTINGEN)6]3+ Men detta kombineras med OH -joner- av vattnet som bildar blandade arter och släpper protoner h+.
Av denna anledning är deras lösningar sura. Om pH ökar bildar dessa arter en gel och slutligen bildas en fällning eller en fast av hydratiserad järnoxid tro2ANTINGEN3 •Nh2ANTINGEN.
Järnkloridkristaller (iii) är hygroskopiska, det vill säga de absorberar vatten från miljön. När det är vått är det frätande för aluminium och många metaller.
 FECL -lösningar3 De kan vara mycket sura och frätande, eftersom de innehåller HCl. Kanesskong/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/4.0). Källa: Wikimedia Commons.
FECL -lösningar3 De kan vara mycket sura och frätande, eftersom de innehåller HCl. Kanesskong/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/4.0). Källa: Wikimedia Commons. Vattenhaltiga lösningar3 De är mycket sura och frätande för de flesta metaller. De har en svag lukt av HCL -saltsyra. När FECL värms upp till dess sönderdelning3 avger mycket giftiga HCl -gaser.
Erhållande
Järnklorid (III) produceras genom direkt klorering av järn genom att reagera torrt klor (CL2) Med järnskrot (tro) vid 500-700 ° C.
Reaktionen utförs i en syraresistent reaktor. Det första steget är att smälta vid 600 ° C en blandning av järnklorid (III) (FECL3) och kaliumklorid (KCl).
 Fecl3 Det måste beredas i behållare som är mycket resistenta mot syror som rostfritt stål. Författare: Johannes Plenio. Källa: Pixabay.
Fecl3 Det måste beredas i behållare som är mycket resistenta mot syror som rostfritt stål. Författare: Johannes Plenio. Källa: Pixabay. Sedan upplöstes järnskrotet (tron) i den smälta blandningen där järn reagerar med FECL3 Och det blir järnklorid (FECL2).
Fe + 2 FECL3 → 3 FECL2
Sedan FECL2 reagerar med klor CL2 bildar FECL3 som sublimerar (passerar från det fasta tillståndet till gasformigt direkt) och samlas in i speciella kondensationskamrar.
2 FECL2 + Kli2 → 2 FECL3
Du kan också reagera järnfesosulfat4 med klor Cl2.
Hexahydrat FECL3 •6h2O Det kan erhållas genom att avdunsta en vattenhaltig lösning av trosjoner3+ och cl- I ångbad.
Kan tjäna dig: kvartära föreningar: egenskaper, träning, exempelNärvaro
Järnklorid eller järnklorid (III) finns i formen i form av Mo -mineralmineralet, som finns i lavan hos aktiva vulkanfumaroler. Bland vulkanerna där du kan hitta är Mount Vesubio.
 Fecl3 Det är en del av Moysite malmen som är i aktiva vulkaner. Författare: Skeze. Källa: Pixabay.
Fecl3 Det är en del av Moysite malmen som är i aktiva vulkaner. Författare: Skeze. Källa: Pixabay. Ansökningar
Vid avloppsrening
Järnklorid används för att behandla kommunalt eller industriellt avloppsvatten genom kemisk sedimentation.
Det fungerar som ett koagulant som gynnar föreningen mellan flera partiklar med varandra, på detta sätt bildas konglomerat eller större partiklar som tenderar att flockna eller sediment (sänka sin egen vikt till botten av vattnet som behandlas).
 Fecl3 Det används för att separera oönskade material från vattnet som kasseras av samhällen eller industrier. Författare: 后园 卓. Källa: Pixabay.
Fecl3 Det används för att separera oönskade material från vattnet som kasseras av samhällen eller industrier. Författare: 后园 卓. Källa: Pixabay. På detta sätt gynnas separationen av vattenfastigheter och detta är fritt från oönskade material.
Denna typ av behandlingar kan underlätta avlägsnande av parasiter, såsom protozoer, som är mikroorganismer som bildas av en enda cell, såsom amibas, som orsakar sjukdom.
Av denna anledning FECL3 Det används också för att rena vatten.
I veterinärläkningsprocedurer
Järnklorid (III) används för att bota djurskador.
Det fungerar som ett lokalt sammandragande (du kan dra tillbaka vävnader och fungera som antiinflammatorisk och läkning) och hemostatisk (det slutar blöda eller blodförluster).
Det används i pulver för att stoppa blodförluster eller när hästar har klippts till nötkreatur. Det används också i en lösning för att stoppa blödningen när klor skärs eller vårtor elimineras.
 Fecl3 Det används i pulver som appliceras på koren skurna horn och undvika infektioner. Författare: Jaclou DL. Källa: Pixabay.
Fecl3 Det används i pulver som appliceras på koren skurna horn och undvika infektioner. Författare: Jaclou DL. Källa: Pixabay. Det används också för att behandla faryngit (farynxinflammation) eller stomatit (inflammation i oral slemhinna) och för att öka blodhemoglobin hos vissa fåglar.
I metallekstraktion
Järnklorid (III) eller järnklorid FECL3 Det används för att extrahera koppar (ii) av kopparmalm som innehåller sulfider av nämnda metall.
Kan tjäna dig: hydroxiderDet är en oxidativ metod som är tillräcklig för att undvika frisättning av toxisk gassvaveldioxid (så2), för istället för detta genereras svavel (er). Lösningar med höga FECL -koncentrationer produceras2, Fecl3, CuCl2 och andra metallklorider.
4 FECL3 + Cu2S ⇔ 4 fecl2 + 2 CUCL2 + S ↓
Som ett reagens av kemiska och biologiska laboratorier
Bland många av dess kemianvändningar tjänar till att indikera närvaron av fenolgruppen (det vill säga grupp -OH fäst vid en bensenring).
Föreningen upplöstes för att analyseras i etanol och några droppar FECL -lösning tillsätts3. När föreningen har en grupp -OH fäst vid en bensenring (det vill säga det är en fenol) bildas en blåaktig grön färg.
Detta test gör det möjligt att analysera närvaron av fenoler i växternas extrakt.
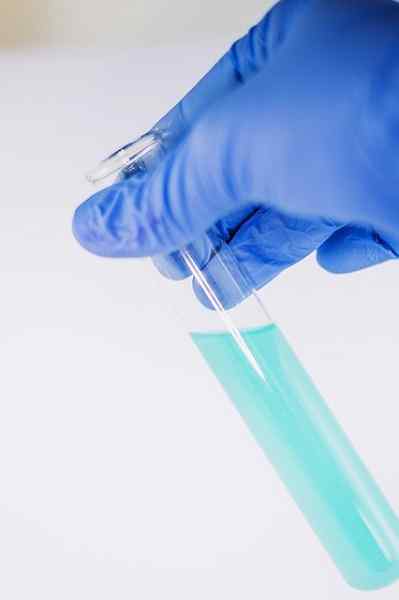 Fecl3 I närvaro av fenoler ger det en blåaktig grön färg. Författare: Ewa Urban. Källa: Pixabay.
Fecl3 I närvaro av fenoler ger det en blåaktig grön färg. Författare: Ewa Urban. Källa: Pixabay. Det används också i tester för att bestämma antioxidantaktiviteten för vissa oljor extraherade från grönsaker.
En annan av dess tillämpningar är att det gör det möjligt att förbereda andra kemiska föreningar. Det kan också fungera som ett oxiderande, klorineringsmedel (ge klor) och kondensor (för att gå med två eller flera molekyler med varandra).
Det fungerar också som katalysator eller accelerator för organiska kemi -reaktioner.
I flera applikationer
Järnklorid används i tryckta elektroniska kretsar. Genom färgningen av dess olika hydratiserade former fungerar det som ett pigment och används i läderbanaren.
 Fecl3 Det används i läderbrun. Författare: Pexels. Källa: Pixabay.
Fecl3 Det används i läderbrun. Författare: Pexels. Källa: Pixabay. Det är desinfektionsmedel. Det används för att behandla hudstörningar och används också i fotografering.
Risker
FECL -pulver3 Det är irriterande för ögonen, näsan och munnen. Om inandning kan orsaka hosta eller andningssvårigheter. Det är en frätande förening, så långvarig kontakt med huden och med ögonen eller slemhinnan kan orsaka rodnad och brännskador.
Det är inte brandfarligt, men när det värms upp vid höga temperaturer producerar HCL vätekloridgas, vilket är giftigt och mycket frätande.
Fecl3 Det är skadligt för vatten- och landorganismer. Om det av misstag kastas till miljön måste dess surhet med basföreningar neutraliseras.
Referenser
- ELLER.S. National Library of Medicine. (2019). Järnklorid. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Kirk-THERMER (1994). Encyclopedia of Chemical Technology. Volym 19. Fjärde upplagan. John Wiley & Sons.
- Ullmanns Encyclopedia of Industrial Chemistry. (1990). Femte upplagan. Volym A22. VCH Verlagsgellschaft MBH.
- Ngameni, b. et al. (2013). Flavonoider och relaterade föreningar från Afrikas medicinalväxter. Karakterisering av flavonoider i växtextrakt. Järnkloridtest. I medicinalväxtforskning i Afrika. Återhämtat sig från Scientedirect.com.
- Agyare, c. et al. (2017). Petroselinum crispum: en recension. Antioxidantaktivitet. I medicinska spartar och grönsaker från Afrika. Återhämtat sig från Scientedirect.com.
- Stott, r. (2003). Parasiternas öde och beteende i avloppsreningssystem. Kemiskt assisterad sedimentation. I handbok för vatten- och avloppsmikrobiologi. Återhämtat sig från Scientedirect.com.
- Tasker, s.TILL. et al. (2003). Tillämpningar av samordningskemi. Extraktion av CUIi Från kloridlösningar. Genom att förstå koordinationskemi. Återhämtat sig från Scientedirect.com.
- Bomull, f. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.

