Blykloridegenskaper, struktur, användningar

- 2058
- 527
- Johan Gustafsson
han blyklorid Det är ett oorganiskt salt vars kemiska formel är PBCLn, Där n är blyens oxidationsnummer. Således, när ledningen är som +2 eller +4, är salt PBCL2 eller PBCL4, respektive. Därför finns det två typer av klorider för denna metall.
Av de två, PBCL2 Det är den viktigaste och stabila; Medan PBCL4 är instabil och mindre användbar. Den första är av jonisk natur, där katjonen PB2+ genererar elektrostatiska interaktioner med Cl -anjonen- att bygga ett kristallint nätverk; Och den andra är kovalent, med PB-CL-länkar som har sitt ursprung i en bly- och klortraedron.
 Utfällda PBCL2 -nålar. Källa: Rrausch1974 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Utfällda PBCL2 -nålar. Källa: Rrausch1974 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] En annan skillnad mellan blyklorider är att PBCL2 Det är ett fast vitt glasformade kristaller (överlägsen bild); Medan PBCL4 Det är en gulaktig olja som kan kristallisera vid -15 ° C. PBCL -ingång2 Det är mer estetiskt än PBCL4.
Förutom de ovannämnda, PBCL2 Det finns i naturen som Cotunite Mineral; Medan PBCL4 Nej, eftersom det är mottagligt för nedbrytningar. Medan från PBCL4 Du kan få PBO2, av PBCL2 De härleder en oändlig variation av organometala föreningar.
[TOC]
Egenskaper
Egenskaperna för blyklorid beror i essensen av blyens oxidationsnummer; Eftersom klor inte förändras, men gör det som det interagerar med bly. Därför måste båda föreningarna hanteras; blyklorid (ii) å ena sidan och blyklorid (iv) å andra sidan.
-Blyklorid (II)
Molmassa
278.10 g/mol.
Fysiskt utseende
Vita färgade kristaller med nålformer.
Densitet
5,85 g/ml.
Smältpunkt
501ºC.
Kokpunkt
950ºC.
Vattenlöslighet
10,8 g/L vid 20 ° C. Det är lite lösligt och vattnet måste värmas så att en betydande mängd kan lösas.
Det kan tjäna dig: nickelhydroxid (ii): struktur, egenskaper, användningar, riskerBrytningsindex
2,199.
Blyklorid (IV)
Molmassa
349,012 g/mol.
Fysiskt utseende
Gulaktig oljig vätska.
Densitet
3,2 g/ml.
Smältpunkt
-15ºC.
Kokpunkt
50ºC. Vid högre temperaturer bryts det ned och släpper gasformigt klor:
Pbcl4(S) => PBCL2(s) + cl2(g)
I själva verket kan denna reaktion vara mycket explosiv, så PBCL lagras4 I svavelsyra vid -80 ° C.
Strukturera
-Blyklorid (II)
Till en början nämndes att PBCL2 Det är en jonisk förening, så den består av Pb -joner2+ och cl- som bygger en kristall där ett Pb -förhållande är etablerat: CL lika med 1: 2; Det vill säga det finns dubbelt såväl som CL -anjoner- Vilka katjoner PB2+.
Resultatet är att ortorrombiska kristaller bildas vars joner kan representeras med en sfär och staplar som i den lägre bilden.
 Kotunitstruktur. Källa: Benjah-Bmm27 [Public Domain].
Kotunitstruktur. Källa: Benjah-Bmm27 [Public Domain]. Denna struktur motsvarar också den för Cotunite Mineral. Även om staplarna används för att indikera en riktning för den joniska länken, bör den inte förväxlas med en kovalent (eller åtminstone rent kovalent) länk).
I nämnda ortorrombiska kristaller PB2+ (Grillian sfärer) Den har nio cl- (Gröna sfärer) som omger honom, som om han var inlåst i ett triangulärt prisma. För strukturen och den låga jontensiteten hos PB2+, Molekylerna är svåra att lösa glaset; Anledningen till att det är lite lösligt i kallt vatten.
Gasformig fasmolekyl
När varken kristallen eller vätskan kan motstå höga temperaturer, börjar jonerna förångas som PBCL -molekyler2 diskret; Det vill säga med CL-PB-CL-kovalenta bindningar och en vinkel på 98º, som om det var en boomerang. Det sägs då att gasfasen består av dessa PBCL -molekyler2 och inte av joner som bärs av luftströmmar.
Kan tjäna dig: elektronegativitetBlyklorid (IV)
Under tiden PBCL4 Det är en kovalent förening. Därför att? Eftersom katjonen PB4+ Den är mindre och har också en större jonbelastningstäthet än PB2+, som orsakar större polarisering av det elektroniska molnet i CL-. Resultatet är att istället för en interaktion mellan den joniska typen PB4+Kli-, PB-CL-kovalenta länken bildas.
Med tanke på detta förstås likheten mellan PBCL4 Och till exempel CCL4; Båda presenteras som tetraedrala individuella molekyler. Således förklaras det varför denna blyklorid är en gulaktig olja under normala förhållanden; Atomerna i CL är några relaterade till varandra och "slip" när två PBCL -molekyler4 De kommer.
Men när temperaturen sjunker och molekylerna blir långsammare ökas sannolikheten och effekterna av omedelbara dipoler (PBCL4 Det är apolar med tanke på dess symmetri); Och sedan fryser oljan som gula hexagonala kristaller:
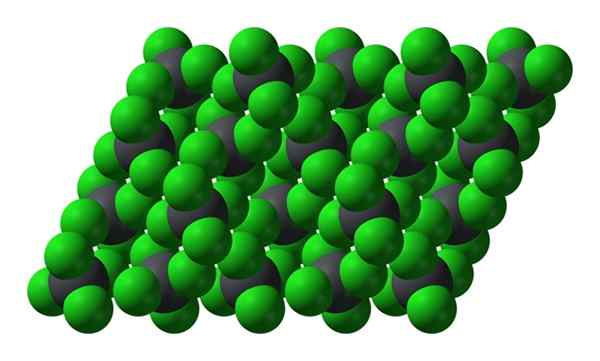 Kristallin struktur av PBCL4. Källa: Benjah-Bmm27 [Public Domain]
Kristallin struktur av PBCL4. Källa: Benjah-Bmm27 [Public Domain] Observera att varje gråaktig sfär är omgiven av fyra gröna sfärer. Dessa PBCL -molekyler4 "Squeered" utgör en instabil kristall och mottaglig för att sönderdelas kraftfullt.
Nomenklatur
Namnen: blyklorid (II) och blyklorid (IV) motsvarar de som tilldelats enligt lager nomenklaturen. Eftersom oxidationsnumret +2 är det minsta för bly och +4 den största, kan båda kloriderna namnges enligt den traditionella nomenklaturen som plumbosklorid (PBCL2) och plúbic klorid (PBCL4), respektive.
Och slutligen är den systematiska nomenklaturen, som belyser antalet av varje atom i föreningen. Således PBCL2 Det är bly diklorid och pbcl4 bly tetraklorid.
Det kan tjäna dig: kemisk ogenomtränglighetAnsökningar
En praktisk användning för PBCL är inte känd4 Förutom att betjäna PBO -syntes2. PBCL2 Det är mer användbart och det är därför endast vissa användningsområden för denna specifika blyklorid listas nedan:
- På grund av dess mycket självlysande natur är den avsedd för fotografiska, akustiska, optiska och strålningsdetektorer.
- Inte absorberar i det infraröda spektrumområdet, det används för tillverkning av glas som överför denna typ av strålning.
- Han har varit en del av vad de kallar Aureno -glaset, ett attraktivt material av iriserande blåaktig färg som används för prydnadsändamål.
- Efter temat konst, när du nås, PBCL2· PB (OH)2 förvärvar intensiva vitaktiga nyanser, med vitt blypigment. Emellertid har dess användning avskräckts på grund av dess höga toxicitet.
- Smält och blandad med bariumtitanat, Batio3, har sitt ursprung i titanato keramik av barium och bly BA1 - xPbxFarbror3. Om en PB2+ Gå in i Batio3, En BA2+ Du måste lämna glaset för att tillåta dess införlivande, och det sägs då att ett katjonbyte inträffar; Det är därför BA: s sammansättning2+ Det uttrycks som 1-x.
- Och slutligen, från PBCL2 Flera organometala föreningar av allmän formel -rumula syntetiseras r4Pb eller r3Pb-pbr3.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Wikipedia. (2019). Bly (ii) klorid. Hämtad från: i.Wikipedia.org
- Kemisk formulering. (2019). Blyklorid (IV). Återhämtad från: Quimica -formulering.com
- Clark Jim. (2015). Kloriderna av kol, kisel och bly. Återhämtat sig från: Chemguide.co.Storbritannien
- Spektral och optiska olinjära studier på blyklorid (PBCL2) Kristaller. [Pdf]. Återhämtat sig från: shodhganga.Infibnet.Växelström.i
- Nationellt centrum för bioteknikinformation. (2019). Blyklorid. PubChem -databas; CID = 24459. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- « Mangankloridegenskaper, struktur, användningar, risker
- Konvertering kostar hur beräknat och exempel »

