Zinkklorid (ZnCl2) struktur, egenskaper, erhållning, användning

- 2197
- 507
- Johan Gustafsson
han zinkklorid Det är en oorganisk förening som bildas av zink- eller zinkelementet (Zn) och klor (CL). Dess kemiska formel är Zncl2. CINC finns i oxidationstillståndet +2 och klor har en Valencia på -1.
Det är ett färglöst eller vitt kristallint fast ämne. Det är mycket lösligt i vatten och absorberar det enkelt från miljön, som kan ses i figuren av det fuktade fasta ämnet som visas nedan.
 FIFCL -klorid2 Solid något hydratiserad. Användare: WalkerMa / Public Domain. Källa: Wikimedia Commons.
FIFCL -klorid2 Solid något hydratiserad. Användare: WalkerMa / Public Domain. Källa: Wikimedia Commons. Zink av denna förening är biologiskt mycket viktigt för människor, djur och växter, eftersom den ingriper i grundläggande funktioner som protein och fettsyntes.
Av denna anledning Zncl2 Det används som ett näringskomplement till djur och människor i fall av zinkbrist och som ett mikronäringsämne för växter.
Den har bakteriostatiska och ansträngande egenskaper och används allmänt för dessa ändamål i både mänsklig och veterinärmedicin. Eliminerar också skadedjur som utomhussvampar och är mellanhand för att få bekämpningsmedel.
Bland dess flera användningsområden tjänar den till att behandla cellulosa- och ullfibrer i olika processer, samt att förbereda dem för färg eller utskrift. Försena också förbränningen av trä.
[TOC]
Strukturera
Zncl2 Det är en jonisk förening som bildas av Zn -katjonen2+ och två anjoner klorid Cl- som binder genom elektrostatiska krafter.
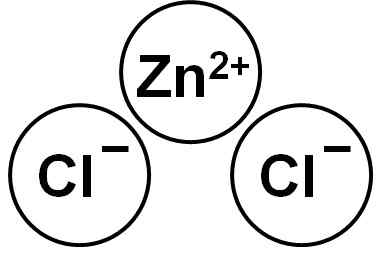 Zinkklorid. Författare: Marilú Stea.
Zinkklorid. Författare: Marilú Stea. Zink (II) -jonen har följande elektroniska struktur:
1s2, 2s2 2 p6, 3s2 3p6 3D10, 4S0,
där det observeras att båda elektronerna i Kap 4S, varigenom konfigurationen är stabil.
Kloridjonen presenterar följande struktur:
1s2, 2s2, 2 p6, 3s2 3p6,
vilket också är mycket stabilt för att ha fullständiga orbitaler.
I figuren kan det sätt på vilket jonerna finns i glaset observeras. Grå sfärer representerar zink och gröna sfärer till klor.
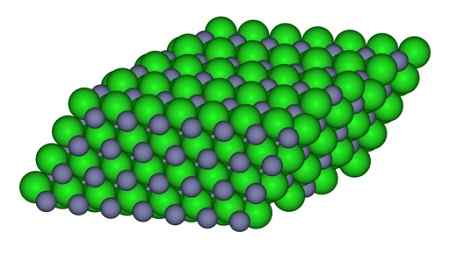 Struktur som bildar jonerna i ZnCl -kristallen2. CCOIL/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0). Källa: Wikimedia Commons.
Struktur som bildar jonerna i ZnCl -kristallen2. CCOIL/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0). Källa: Wikimedia Commons. Nomenklatur
- Zinkklorid (II)
- Zinkdiklorid
Egenskaper
Fysiskt tillstånd
Färglöst fast eller kristallint vitt. Hexagonala kristaller.
Molekylvikt
136,3 g/mol
Smältpunkt
290 ºC
Kokpunkt
732 ºC
Densitet
2 907 g/cm3 vid 25 ° C
Löslighet
Mycket lösligt i vatten: 432 g/100 g h2Eller vid 25 ° C, 614 g/100 g h2Eller 100 ° C. Mycket löslig i saltsyra (HCL), alkohol och glycerol. Helt blandbar.
Kan tjäna dig: kvicksilverhydroxid: struktur, egenskaper, användningar, riskerpH
Dess vattenhaltiga lösningar är sura. En lösning av 6 mol ZnCl2/L har ett pH på 1,0.
Kemiska egenskaper
Det är en hygroskopisk och delikoscenterande, eftersom i kontakt med miljöens fuktighet absorberar den mycket vatten. I vatten är det hydrolyserat och har tendensen att bilda en grundläggande olöslig zinkoxiklorid.
Reagerar med zinkoxid (ZnO) i vatten som genererar zinkoxiklorider som utgör ett extremt hårt cementmaterial.
Det är försiktigt frätande mot metaller.
Det är inte brandfarligt.
Biologisk roll
Biologiskt är zink ett av de viktigaste elementen. Det har erkänts som väsentligt för alla livsstil.
I människokroppen Zncl2 Zn tillhandahåller, vilket är viktigt för protein, kolesterol och fettsyntes. Särskilt CINC är viktigt för immunsystemets korrekt funktion.
 Zink zncl2 Det är viktigt för celldelning i levande varelser. Ladyofhats / allmän domän. Källa: Wikimedia Commons.
Zink zncl2 Det är viktigt för celldelning i levande varelser. Ladyofhats / allmän domän. Källa: Wikimedia Commons. Mer än 25 proteiner som innehåller zink har identifierats, och många av dessa är enzymer, nödvändiga vid celldelning och tillväxt, och för frisättning av vitamin A från levern.
Cinc -brist kan leda till tillväxt i tillväxt, deprimerad mental funktion, anorexi, dermatit, minskning av immunitet, diarré och dålig nattvision, bland andra förhållanden.
Erhållande
Kommersiellt framställs denna förening genom att reagera vattenhaltig saltsyra med skrot, zinkavfall eller med mineralet som innehåller det. I denna reaktion finns det också gasväte (h2).
Behandling av zink med väteklorid vid 700 ° C erhålls.
Zn + HCl → ZnCl2 + H2↑
Ansökningar
I terapeutiska behandlingar
Det är en mjuk eller bakteriostatisk antibakteriell, så den används i vaginal duschar för att eliminera Tricomonas eller Haemophilus -infektioner. Det tjänar också till att behandla kallus, som en sammandragande och i Chemiocirugia i hudcancer.
Det används som sammandragande i vissa kosmetika som uppfriskande lotioner för huden.
Som näringstillskott
På grund av dess betydelse i olika funktioner hos den mänskliga organmen2 Det administreras muntligt som en del av näringstillbehör och även hos personer som behöver parenteral mat.
ZNCL -tillskott2 De levereras för att behandla zon.
Kan tjäna dig: homogen blandning ZNCL -tillskott2 De bör användas när det finns zinkbrist. Författare: Moakets. Källa: Pixabay.
ZNCL -tillskott2 De bör användas när det finns zinkbrist. Författare: Moakets. Källa: Pixabay. Friska individer förvärvar det genom mat.
Det bör levereras minst 1 timme före måltider eller 2 timmar efter dessa, eftersom vissa livsmedel kan förhindra deras absorption. Hos patienter som har magirritation efter intag bör intag av det med måltider, men på detta sätt kommer zink att vara mindre biodisononontabel.
I veterinärapplikationer
Dess lösningar har använts hos djur som ett kaustiskt medel för att bränna eller caulbody fistlar, som är förbindelser mellan organ som inte är normala eller friska; I form av pasta tjänar till att behandla sår och cancerkemoterapi.
 De vattenhaltiga lösningarna av ZnCl2 De används för att behandla djurögoninfektioner. Författare: Mabel Amber. Källa: Pixabay.
De vattenhaltiga lösningarna av ZnCl2 De används för att behandla djurögoninfektioner. Författare: Mabel Amber. Källa: Pixabay. Vid ögoninfektioner fungerar en mycket utspädd lösning av denna förening som ett antiseptiskt och ansträngande.
Det används också som spår i djurfoder eller som ett mattillskott.
I specialcement
Reaktionen mellan ZnCl2 Och ZnO i vatten producerar en viss zinkoxiklorid som utgör ett extremt hårt eller cementmaterial. De viktigaste beståndsdelarna är 4Zno • Zncl2• 5h2O och ZnO • Zncl2• 2h2ANTINGEN.
Denna typ av cement motstår attacken av syra eller kokande vatten. Pentahydratet är emellertid mycket stabilt och olösligt men oföränderligt och dihydratet är mer lösligt och kan orsaka flytande dränering.
Av dessa skäl har dessa cement få tillämpningar.
Som katalysator
Det tjänar till att påskynda vissa organiska kemi -reaktioner. Fungerar som en kondensoragent. Till exempel i aldoliska reaktioner, amineringsreaktioner och cykeltilläggsreaktioner. I några av dessa handlingar som en radikal initiativtagare.
Det är en Lewis-syra och katalyserar Diels-Alder-reaktioner. Det används också som en katalysator i Friedel-hantverksreaktioner, för att tillverka färgämnen och färgämnen och i tillverkningen av polyesterpolitiska hartser.
Nedan är en reaktion där denna förening ingriper:
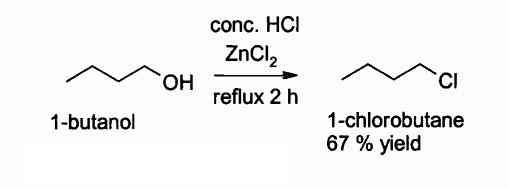 Reaktion av att erhålla en alkylklorid med användning av ZnCl2. Författare: Walkerma. Källa: Wikimedia Commons.
Reaktion av att erhålla en alkylklorid med användning av ZnCl2. Författare: Walkerma. Källa: Wikimedia Commons. I jordbruksverksamhet
Det har använts som en herbicid i grödor, som en bladbehandling, för att eliminera skadedjur som svampar och mossa och som mikronäringsämne. Det är mellanhand att förbereda bekämpningsmedel.
I tandläkare
Det används i munntvättar, men den rekommenderade kontakttiden är mycket kort, så den fungerar bara som en sammandragande i oral slemhinnan. Det fungerar som desensitizer, den används i tandkött och är en del av tandcement.
Kan tjäna dig: natriumklorit (NaClo2): Struktur, egenskaper, användningar, riskerInom textil- och pappersindustrin
Det är en ingrediens i lösningsmedlet som används vid tillverkning av rayon eller konstgjord siden från cellulosa. Det är en retikulering eller facklig medel för hartser efterbehandling på textilier. Det tjänar också till att behandla dem och gynna deras bevarande.
Det gör det möjligt att krulla tyger, separera siden- och ullfibrer och fungerar som en mordant i tryckning och färgning av textilier.
Det används vid tillverkning av pappersrullar och för att producera crepe -papper.
Vid beredning av nanopartiklar
Genom att reagera zinkklorid med natriumsulfid (NA2S) genom en sonokemisk metod och i närvaro av vissa organiska föreningar erhålls nanopartiklar av zinksulfid (ZNS). Sonokemiska metoder använder ljudvågor för att orsaka kemiska reaktioner.
Denna typ av nanomaterial kan ha applicering som fotokatalytiska medel för att till exempel producera vattendelningen i dess komponenter (väte och syre) genom ljusa verkan.
I flera applikationer
- Deodorant, antiseptiskt och desinfektionsmedel i områden. Moss, mögel och svampkontroll i yttre angränsande strukturer och områden som trottoarer, gårdar och staket. Desinfektionsmedel av toaletter, urin, mattor och komprimerat trä.
- Används i blandningar för balmar och lösningar för bevarande av anatomiska prover.
- Träflamskyddare.
- Primär ingrediens i rökpumpar som används för att sprida en mängd människor; Brandmän använder dem i brandbekämpningsövningar och praxis.
 Cinc -klorid används i rökpumpar som används i militära övningar. ELLER.S. Department of Defense Current Photoscpl. Abraham Lopez / 2nd Marine Division / Public Domain. Källa: Wikimedia Commons.
Cinc -klorid används i rökpumpar som används i militära övningar. ELLER.S. Department of Defense Current Photoscpl. Abraham Lopez / 2nd Marine Division / Public Domain. Källa: Wikimedia Commons. - Svetflödeskomponent. I metallinspelning. För stålfärgning, galvaniserad och järnfanérbadrumskomponent med koppar.
- I magnesium- och metallcementcement.
- För att bryta emulsioner i oljeraffinering. Agent i asfalttillverkning.
- Elektrolyt i torkade batterier.
 Torrt ZnCl -batteri2. Användare: 32bitmaschine; Redigerad av användaren JayBear/CC BY-S (https: // CreativeCommons.Org/licenser/BY-SA/3.0). Källa: Wikimedia Commons.
Torrt ZnCl -batteri2. Användare: 32bitmaschine; Redigerad av användaren JayBear/CC BY-S (https: // CreativeCommons.Org/licenser/BY-SA/3.0). Källa: Wikimedia Commons. - Vulkanisering av gummi.
- Uttorkningsmedel.
Risker
Det kan orsaka brännskador för ögon, hud och slemhinnor.
När den värms upp till hans sönderdelning avger giftigt väteklorid (HCl) och zinkoxid (ZnO).
Varning om dess användning som läkemedel
Även om avgörande studier saknas, uppskattas det att om denna förening administreras till gravida kvinnor, kan det orsaka skador på fostret. Men potentiella fördelar kan ha mer vikt än möjliga risker.
Referenser
- ELLER.S. National Library of Medicine. (2019). Kloridzink. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Liska, m. et al. (2019). Specialcement. Zinkoxikloridcement. I Lea's Chemistry of Cement and Concrete (Fifth Edition). Återhämtat sig från Scientedirect.
- Pohanish, r.P. (2017). Kloridzink. I Sittigs handbok av giftiga och farliga kemikalier och cancercinagener (sjunde upplagan). Återhämtat sig från Scientedirect.com.
- Gedanken, a. och Perelshtein, jag. (2015). Kraft ultraljud för produktion av nanomaterial. I Power Ultrasonics. Återhämtat sig från Scientedirect.
- Archibald, s.J. (2003). Övergångsmetallgrupper 9-12. Reaktioner och katalys. För att förstå koordinationskemi ii. Återhämtat sig från Scientedirect.com.
- Bomull, f. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- Bly, D.R. (redaktör) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- « Zinkkromatstruktur, egenskaper, erhållning, användning
- Zinknitratstruktur, egenskaper, erhållning, användning »

