Zinknitratstruktur, egenskaper, erhållning, användning

- 4882
- 207
- Prof. Erik Johansson
han zinknitrat Det är en oorganisk förening som bildas av zink (Zn), kväve (N) och syre (O) -element (O). Zinkens oxidationsstatus är +2, kväve är +5, och syre är -2.
Dess kemiska formel är Zn (nej3)2. Det är en solid färglös kristallin som tenderar att absorbera vatten från miljön. Det kan erhållas genom att behandla zinkmetallen med utspädd salpetersyra. Det är en starkt oxiderande förening.
 Femr Zn -nitrat (nej3)2. Ondřej Mangl / Pub Domain. Källa: Wikimedia Commons.
Femr Zn -nitrat (nej3)2. Ondřej Mangl / Pub Domain. Källa: Wikimedia Commons. Det fungerar som en organisk kemi reaktioner accelerator och gör att du kan få sammansatta polymerer med elkörningsegenskaper. Det används för att bilda lager av användbara material i elektronik.
Det är en del av vissa flytande gödselmedel och vissa långsamma herbicider. Hjälp vid framställning av komplexa oxider som förbättrar din densitet och elektrisk konduktivitet.
Det har testats framgångsrikt för att erhålla strukturer som fungerar som grund för regenerering och tillväxt av benvävnad, förbättrar denna process och resulterar i en antibakteriell.
Även om det inte är bränsle kan det påskynda förbränningen av ämnen som är, till exempel kol eller organiska material. Det är irriterande hud, ögon och slemhinnor och är mycket giftigt för vattenlevande liv.
[TOC]
Strukturera
Zinknitrat är en jonisk förening. Den har en bivalent katjon (Zn2+) och två monovalenta anjoner (nej3-). Nitratanjon är en polyiatomisk jon bildad av en atom av kväve i dess oxidationstillstånd +5 fäst vid tre syreatomer med Valencia från -2.
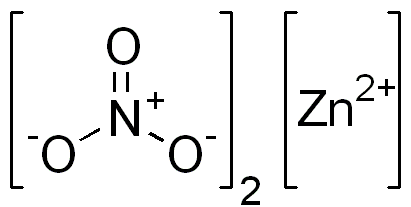 Jonisk nitratstruktur av zink. Edgar181 / pubdomän. Källa: Wikimedia Commons.
Jonisk nitratstruktur av zink. Edgar181 / pubdomän. Källa: Wikimedia Commons. Bilden nedan visar den rumsliga strukturen för denna förening. Den grå centrala sfären är zink, blå sfärer är kväve och röda sfärer representerar syre.
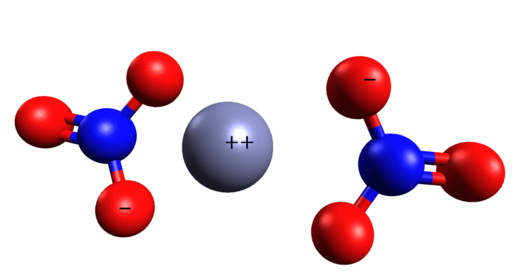 Rumslig struktur av Zn (nej3)2. Cinc är mitt i nitratjoner. Grasso Luigi/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/4.0). Källa: Wikimedia Commons.
Rumslig struktur av Zn (nej3)2. Cinc är mitt i nitratjoner. Grasso Luigi/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/4.0). Källa: Wikimedia Commons. Nomenklatur
- Cinc -nitrat
- Zinkdinitrat
Egenskaper
Fysiskt tillstånd
Färglöst fast eller kristallint vitt.
Molekylvikt
189.40 g/mol
Smältpunkt
Ungefär 110 ºC.
Det kan tjäna dig: Iarhydric Acid (HI): Struktur, egenskaper och användningarKokpunkt
Ungefär 125 ºC.
Densitet
2,065 g/cm3
Löslighet
Vattenlöslig: 120 g/100 g h2Eller vid 25 ° C. Alkohol.
pH
Dess vattenhaltiga lösningar är sura. En lösning på 5% har ett pH på cirka 5.
Kemiska egenskaper
För att vara en nitrat är denna förening en stark oxidant. Reagerar våldsamt med kol, koppar, metallsulfider, organiskt material, fosfor och svavel. Om det sprayas på heta kolutnyttjar.
Å andra sidan är det hygroskopiskt och absorberar vatten från miljön. Om zinkoxidform, kväve och syre dioxid:
2 Zn (nej3)2 + Värme → 2 ZnO + 4 Nej2↑ + O2↑
I alkaliska lösningar, såsom NaOH, bildar zink för denna förening dess hydroxid och andra komplexa arter:
Zn (nej3)2 + 2 åh- → Zn (OH)2 + 2 Nej3-
Zn (OH)2 + 2 åh- → [Zn (OH)4]2-
Erhållande
Det kan erhållas genom att behandla zink- eller zinkoxid med utspädd salpetersyra. Vätgas gas bildas i denna reaktion.
Zn + 2 hno3 → Zn (nej3)2 + H2↑
Ansökningar
Reaktioner katalys
Det används som en katalysator för att erhålla andra kemiska föreningar såsom hartser och polymerer. Det är en syrakatalysator.
 Hartsexempel. Bugman på engelska Wikipedia / allmän domän. Källa: Wikimedia Commons.
Hartsexempel. Bugman på engelska Wikipedia / allmän domän. Källa: Wikimedia Commons.  Polymerstrukturmodell. Ilmari Karonen / pubdomän. Källa: Wikimedia Commons.
Polymerstrukturmodell. Ilmari Karonen / pubdomän. Källa: Wikimedia Commons. Ett annat fall av reaktioner acceleration är det katalytiska systemet för Zn (nej3)2/VOC2ANTINGEN4, vilket tillåter oxidation av a-hydrolyster till a-zo-stressar med 99% omvandling även vid miljötrycket och temperaturen.
I sammansatta polymerer
Polymetylmetakrylat och Zn -filmer har utvecklats (nej3)2 Med elektriska konduktivitetsegenskaper som gör att de är lämpliga kandidater som ska användas i superkakor och datorer med hög hastighet.
I oxystcement
Med vattenhaltiga zinknitratlösningar och zinkoxidpulver erhålls material som tillhör klassen av cement som genereras av en syrasreaktion.
Dessa har ett rimligt motstånd mot upplösning i utspädda syror och alkalier, och utvecklar kompressionsresistenskomprimering jämfört med den för annan cement.
Den här egenskapen ökar när ZnO/Zn -förhållandet ökas (nej3)2, Och när Zn -koncentrationen laddas upp (nej3)2 I lösningen. De erhållna cementen är helt amorfa, det vill säga de har inte kristaller.
Kan tjäna dig: kemisk nederbörd Med zinknitrat har tester för att få cement genomförts. Författare: Kobthanapong. Källa: Pixabay.
Med zinknitrat har tester för att få cement genomförts. Författare: Kobthanapong. Källa: Pixabay. I beläggningar och nanomaterial av zinkoxid
Zn (nej3)2 Det används för elektrolytisk avsättning av mycket tunna skikt av zinkoxid (ZnO) på olika underlag. Nanostrukturer av denna oxid framställs också på ytorna.
 Zinkoxid -nanopartiklar. Vissa ZnO -nanostrukturer kan framställas med Zn (nej3)2. Verena Wilhelmi, Ute Fischer, Heike Weighardt, Klaus Schulze-Osthoff, Carmen Nickel, Burkhard Stahlmecke, Thomas A. J. Kuhlbusch, Agnes M. Scherbart, Charlotte Esser, Roel P. F. Schins, Catrin Albrecht/CC av (https: // Creativecommons.Org/licenser/av/2.5). Källa: Wikimedia Commons.
Zinkoxid -nanopartiklar. Vissa ZnO -nanostrukturer kan framställas med Zn (nej3)2. Verena Wilhelmi, Ute Fischer, Heike Weighardt, Klaus Schulze-Osthoff, Carmen Nickel, Burkhard Stahlmecke, Thomas A. J. Kuhlbusch, Agnes M. Scherbart, Charlotte Esser, Roel P. F. Schins, Catrin Albrecht/CC av (https: // Creativecommons.Org/licenser/av/2.5). Källa: Wikimedia Commons. ZnO är ett material av stort intresse på grund av mängden applikationer inom området Optolectronics, det har också halvledaregenskaper och används i sensorer och givare.
I herbicider
CINC -nitrat har använts tillsammans med vissa organiska föreningar för att minska frisättningshastigheten för vissa herbicider i vatten. Den långsamma frisättningen av dessa produkter gör att de kan vara tillgängliga för längre och mindre applikationer krävs.
I ANOD -tillverkning
Stimulerar sintringsprocessen och förbättrar densiteten för vissa oxider som tjänar till att göra anod för bränsleceller. Sintring får ett fast material genom uppvärmning och komprimering av ett pulver utan att nå sin fusion.
 Rita hur två korn sintring inträffar. Zn (nej3)2 Hjälp med att utföra denna process på vissa komplexa oxider. CDANG / PUB -domän. Källa: Wikimedia Commons.
Rita hur två korn sintring inträffar. Zn (nej3)2 Hjälp med att utföra denna process på vissa komplexa oxider. CDANG / PUB -domän. Källa: Wikimedia Commons. Materialen där testerna har utförts är komplexa oxider av strontium, iridium, järn och titan. Närvaron av FAL ökar den elektriska konduktiviteten avsevärt.
Andra appar
Det används för att få droger. Det fungerar som en mordant i applicering av bläck och färgämnen. Tjänar som latex koagulant. Det är en källa till zink och kväve i flytande gödselmedel.
Potentiell användning i benvävnadsteknik
Denna förening har använts som ett tillsatsmedel i utarbetandet av rustningar eller ramar för regenerering av benfibrer, eftersom den gör det möjligt att förbättra dessa strukturers mekaniska motstånd.
Kan tjäna dig: Germanio: Historia, egenskaper, struktur, erhållning, användningDet har observerats att ställningen som innehåller fift inte är giftigt för osteoprogenitorceller, stöder aktiviteten hos osteoblaster som är cellerna som tillverkar ben och förbättrar deras vidhäftning och spridning.
Gynnar bildningen av apatita som är mineralet som bildar benen och också utövar en antibakteriell effekt.
 Zn (nej3)2 Det kan vara mycket användbart för rekonstruktion av benämnen hos personer som har lidit olyckor. Mariano Coretti/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/4.0). Källa: Wikimedia Commons.
Zn (nej3)2 Det kan vara mycket användbart för rekonstruktion av benämnen hos personer som har lidit olyckor. Mariano Coretti/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/4.0). Källa: Wikimedia Commons. Risker
Det är ett material med potentiell risk för brand och explosion.
Det är inte bränsle utan påskyndar förbränningen av brännbara material. Om en stor mängd av denna förening är involverad i en brand eller om det brännbara materialet är fint uppdelat, kan en explosion uppstå.
När de utsätts för stark värme produceras toxiska kväveoxider. Och om exponeringen genomförs långvarig kan den explodera.
Det är irriterande för huden, det kan orsaka allvarliga skador på ögonen, irritation i luftvägarna, det är giftigt på grund av intag och orsakar skador på matsmältningskanalen.
Mycket giftigt för vattenlevande liv med effekter som varar.
Referenser
- Ju och. et al. (2019). Nylig effekt av zinknitrat/vanadyloxalat för selektiv katalytisk oxidation av alfa-hydroximestrar till alfa-keto-esers med molekylär syre: en in situ. Molekyler 2019, 24, 1281. MDPI återhämtade sig.com.
- Mohd s., S.N. et al. (2020). Kontrollerad frisättningsformulering av zinkhydroxidnitrat intercalated med natriumdodecylsulp och bispyribac -anjoner: en ny herbicid nanokomposit för paddyodling. Arabian Journal of Chemistry 13, 4513-4527 (2020). Återhämtat sig från Scientedirect.
- Man, m.P. et al. (2019). Anrikad mekanisk styrka och benmineralisering av biomimetiska ställningar i elektrospunet med ylang ylang olja och zinknitrat för benvävnadsteknik. Polymerer 2019, 11, 1323. MDPI återhämtade sig.com.
- Kim, k.Yo. et al. (2018). Effekter av zinknitrat som ett sintringshjälpmedel på de elektokemiska egenskaperna hos SR0,92OCH0,08Farbror3-delta och herr0,92OCH0,08Du0.6Tro0,4ANTINGEN3-delta Ceramics International, 44 (4): 4262-4270 (2018). Återhämtat sig från Scientedirect.com.
- Prasad, b.OCH. et al. (2012). Elektrodeposition av ZnO -beläggning från vattenhaltig Zn (nej3)2 Bad: Effekt av Zn -koncentration, temperaturavsättning och tid på orientering. J Solid State Electochem 16, 3715-3722 (2012). Länk återhämtat sig.Kandare.com.
- Bahadur, h. och Srivastava, till.K. (2007). Morfologier av sol-gel-härdade tunna filmer av ZnO med olika föregångsmaterial och deras nanostrukturer. Nanoscale Res Lett (2007) 2: 469-475. Länk återhämtat sig.Kandare.com.
- Nicholson, J.W. och Tibaldi, J.P. (1992). Bildning och egenskaper hos cement framställt av zinkoxid och vattenhaltiga lösningar av zinknitrat. J Mater Sci 27, 2420-2422 (1992). Länk återhämtat sig.Kandare.com.
- Bly, D.R. (redaktör) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Maji, s. et al. (2015). Effekt av Zn (nej3)2 Fyllmedel på den dielektriska demilliteten och elektriska modulen i PMMA. Bull Mater Sci 38, 417-424 (2015). Länk återhämtat sig.Kandare.com.
- ELLER.S. National Library of Medicine. (2019). Zinknitrat. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Byju. (2020). Zinknitrat - Zn (No3) 2. Återhämtat sig från byju.com.
- Amerikanska element. Zinknitrat. Återhämtat sig från amerikanerna.com.
- Bomull, f. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- « Zinkklorid (ZnCl2) struktur, egenskaper, erhållning, användning
- Konkreta fall av etiskt förfarande i institutioner och organisationer »

