Forrous Chloride (FECL2) Struktur, användningar, egenskaper

- 5013
- 1534
- Anders Larsson
han järnklorid Det är ett oorganiskt fast ämne som bildas av föreningen av en troskation2+ och två anjoner klorid Cl-. Dess kemiska formel är FECL2. Det tenderar att absorbera vatten från miljön. En av dess hydrater är fecl -tetrahydrat2 •4 timmar2Eller som är en grönaktig solid.
Markera att det är mycket lösligt i vatten och tenderar att enkelt oxidera i närvaro av luft som bildar den järnhaltiga FECL -kloriden3. För att vara lätt oxiderbar och därför kan fungera som en reducerare används allmänt i kemiska och biologiska forskningslaboratorier.
 Ferroso tetrahydratklorid FECL2 •4 timmar2Eller solid. Craven [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons.
Ferroso tetrahydratklorid FECL2 •4 timmar2Eller solid. Craven [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons. Järnklorid har flera användningsområden bland vilka för att hjälpa andra medel vid oxidation av slam härrörande från avloppsvatten eller avloppsbehandling. Det används också i metalljärnbeläggningsprocessen och har vissa användningsområden inom läkemedelsindustrin.
FECL -användning har också upplevts2 I återhämtningen av värdefulla metaller i de förbrukade katalysatorerna som finns i avgasrören av fordon som arbetar med bensin eller diesel.
Det används i textilindustrin för att fixa färger i vissa typer av tyg.
[TOC]
Strukturera
Järnklorid bildas av en järnhaltig trojon2+ och två joner klorid Cl- Förenade genom joniska länkar.
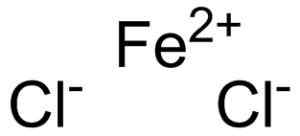 Ferroso kloruro fecl2 var är jonerna som utgör det. EPOP [Public Domain]. Källa: Wikimedia Commons.
Ferroso kloruro fecl2 var är jonerna som utgör det. EPOP [Public Domain]. Källa: Wikimedia Commons. Den järnhaltiga tron2+ Den har följande elektroniska struktur:
1s2, 2s2 2 p6, 3s2 3p6 3D6, 4S0
där du kan se att du tappade två elektroner i 4S -lagret.
Denna konfiguration är inte särskilt stabil, och av denna anledning tenderar den att oxidera, det vill säga förlora en annan elektron, denna gång av 3D -skiktet och bildar tronjonen3+.
För sin sida- Den har följande elektroniska struktur:
1s2, 2s2 2 p6, 3s2 3p6
där du kan se att du skaffade dig en extra elektron i skikt 3p och slutför den. Denna konfiguration är mycket stabil eftersom alla elektroniska lager är kompletta.
Nomenklatur
- Järnklorid
- Järnklorid (ii)
Det kan tjäna dig: Bestämning av aska: Metoder och exempel- Järndiklorid
- Tetrahydrat järnklorid: FECL2 •4 timmar2ANTINGEN
Egenskaper
Fysiskt tillstånd
Färgglad till blekgrön, kristaller.
Molekylvikt
126,75 g/mol
Smältpunkt
674 ºC
Kokpunkt
1023 ºC
Spännande vikt
3,16 till 25 ºC/4 ºC
Löslighet
Mycket lösligt i vatten: 62,5 g/100 ml vid 20 ºC. Löslig i alkohol, aceton. Något lösligt i bensen. Praktiskt taget olöslig i eter.
Andra egenskaper
Fecl2 Vattenfri är mycket hygroskopisk. Absorbera vatten med lätthet av miljön och bildar en mängd olika hydrater, särskilt tetrahydratet, där för varje FECL -molekyl2 Det finns 4 timmars molekyler2Eller länkad till detta (FECL2 •4 timmar2ANTINGEN).
I närvaro av luft oxiderar det långsamt till FECL3. Detta betyder att tronjonen2+ Oxiderar lätt jon tro3+.
Om du värms upp i närvaro av snabb luftjärnklorid FECL3 Och järnoxid Fe2ANTINGEN3.
Fecl2 Det är frätande för metaller och vävnader.
Erhållande
Det erhålls genom att behandla ett överskott av järn tro med vattenlösning av HCl -saltsyra vid höga temperaturer.
Tro0 + 2 HCl → FECL2 + 2 h+
På grund av närvaron av vatten genom denna metod erhålls emellertid järntrahydratklorid2 •4 timmar2ANTINGEN.
För att erhålla vattenfri (utan vatten införlivat i kristallerna) har vissa forskare valt att utföra reaktionen av järndamm med vattenhaltiga kullar (utan vatten) i tetrahydrofuranlösningsmedlet (THF) vid en temperatur av 5 ° C.
FECL -föreningen erhålls på detta sätt2 •1,5thf, som när den värms upp till 80-85 ºC i tomrummet eller i kväveatmosfär (för att undvika närvaron av vatten) producerar FECL2 vatten-.
Ansökningar
Järnklorid har olika användningsområden baserat på dess reducerande kapacitet, det vill säga den kan lätt oxideras. Det används till exempel i målningar och beläggningar, eftersom det hjälper till att fixa dem från ytan.
Järn är ett viktigt mikronäringsämne för människors hälsa och vissa djur. Det är involverat i proteinsyntes, andning och multiplikation av celler.
Därför FECL2 Det används i farmaceutiska beredningar. Tronjonen2+ Som sådan absorberas det bättre än tronjonen3+ I tarmen.
Kan tjäna dig: kalciumkarbonat: struktur, egenskaper, bildning, användningDet används för FECL -tillverkning3. Det används i metallurgi, i järnbeläggningar, för att ge en mer duktil insättning.
Här är andra framträdande användningsområden.
I tygfärgning
Fecl2 Det används som en mordant eller färgfixativ i vissa typer av tyg. Mordanten reagerar kemiskt och förenar sig samtidigt på färgämnet och tyget som bildar en olöslig förening på detta.
På detta sätt är färgämnet fixerat på tyget och dess färg intensifieras.
 Järnhaltig klorid FECL2 Gör att färger kan fixas på tyger. Gina Pina [CC av 2.0 (https: // CreativeCommons.Org/licenser/av/2.0)]. Källa: Wikimedia Commons.
Järnhaltig klorid FECL2 Gör att färger kan fixas på tyger. Gina Pina [CC av 2.0 (https: // CreativeCommons.Org/licenser/av/2.0)]. Källa: Wikimedia Commons. Vid avloppsrening
Fecl2 Det används i avloppsvatten eller avfallsbehandlingsanläggningar (avloppsvatten).
I denna applikation deltar järnkloriden i oxidationen av leran, genom en process som kallas fentonoxidation. Denna oxidation orsakar brottet av leraflokkler och tillåter frisättning av vatten som är starkt fäst vid detta.
 Avsnitt av en avloppsreningsverk där du kan se leran. Ibland behandlas detta med Ferroso FECL -klorid2 så att det lättare kan separeras från vatten. Evelyn Simak/Sewage Works norr om Dickleburgh. Källa: Wikimedia Commons.
Avsnitt av en avloppsreningsverk där du kan se leran. Ibland behandlas detta med Ferroso FECL -klorid2 så att det lättare kan separeras från vatten. Evelyn Simak/Sewage Works norr om Dickleburgh. Källa: Wikimedia Commons. Då kan leran torka och kasta. Användningen av järnklorid hjälper till att minska processkostnaderna.
Det har också nyligen föreslagits för att minska bildningen av sulfidgas eller vätesulfid i nämnda avlopp med avlopp.
På detta sätt skulle korrosionen som produceras av denna gas och den obehagliga lukten minskas.
I kemiska studier
För sina reducerande egenskaper (motsatsen till oxidation) FECL2 Det används ofta i olika forskning inom kemi, fysik och ingenjörslaboratorier.
Vissa forskare använde järnkloridånga.
Dessa katalysatorer används för att eliminera skadliga gaser för människan och miljön. De är belägna i flyktröret av bilar och lastbilar som arbetar med bensin eller diesel.
Kan tjäna dig: Molmassa: Hur det beräknas, exempel och lösta övningar Avgasröret av ett fordon där en mer omfattande sektion observeras som är där katalysatorn är belägen för att omvandla skadliga gaser till vänliga gaser med miljön. AHANIX1989 på engelska Wikipedia [Public Domain]. Källa: Wikimedia Commons.
Avgasröret av ett fordon där en mer omfattande sektion observeras som är där katalysatorn är belägen för att omvandla skadliga gaser till vänliga gaser med miljön. AHANIX1989 på engelska Wikipedia [Public Domain]. Källa: Wikimedia Commons. Efter en viss tid tillbringas katalysatorn för fordonet och förlorar effektiviteten och du måste byta ut den. Den förbrukade katalysatorn kasseras och ansträngningar görs för att återvinna de värdefulla metaller som den innehåller.
 Keramisk rutnät av katalysatorn där spåren av värdefulla metaller för att återhämta sig med FECL är belägna2. Global-Kat Recycling [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons.
Keramisk rutnät av katalysatorn där spåren av värdefulla metaller för att återhämta sig med FECL är belägna2. Global-Kat Recycling [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons. Enligt forskarna bildade dessa metaller med järn av järnkloriden magnetiska legeringar.
Legeringarna kunde extraheras med magneter och återvann sedan de värdefulla metallerna med redan kända metoder.
I biokemiska studier
För att ha troskatjonen2+, vilket är ett viktigt mikronäringsämne hos människan och vissa djur, FECL2 Det används i biokemi- och medicinstudier.
Vissa studier tillåtet att visa att järnklorid förbättrar svampdödande effektivitet av argon kall plasma.
Kall plasma är en teknik som används för sterilisering av medicinska ytor och instrument. Det är baserat på bildandet av hydroxylradikaler Oh · Från miljöens fuktighet. Dessa radikaler reagerar med cellväggen i mikroorganismen och orsakar deras död.
I denna undersökning2 Effekten av kall plasma förbättrades och påskyndade eliminering av en svamp som är resistent mot andra desinfektionsmetoder.
Vissa forskare fann att användningen av FECL2 Det möjliggör ökande prestanda i glukos som får reaktioner baserade på sockerrör bagasse.
I detta fall, att vara tro2+ Ett väsentligt mikroement för människors hälsa, dess närvaro i spår i produkten skulle inte påverka människan.
Referenser
- Fukuda, s. et al. (2019). Järnklorid och järnhaltig sulfat förbättrar svampdödande effektivitet av kall atmosfärisk argonplasma på melaniserade aureobasidium pullulans. J Biosci Bioeng, 2019, 128 (1): 28-32. NCBI återhämtade sig.Clm.Nih.Gov.
- Ismal, eller.OCH. och Yildirim, L. (2019). Metallgaggar och biomordanter. I påverkan och utsikterna för grön kemi för textileknologi. Kapitel 3, sid.57-82. Återhämtat sig från Scientedirect.com.
- Zhang, w. et al. (2019). Samkatalys av magnesiumklorid och järnklorid för xylo-oligosackarider och glukosproduktion från sockerrörsbagasse. Bioresoral Technol 2019, 291: 121839. NCBI återhämtade sig.Nlm.Nih.Gov.
- Zhou, x. et al. (2015). Roll av inhemskt järn vid förbättring av slamavvattningsbarhet Denna peroxidation. Vetenskapliga rapporter 5: 7516. NCBI återhämtade sig.Nlm.Nih.Gov.
- Rathnayake, D. et al. (2019). Vätesulfidkontroll i avlopp genom att katalysera reaktionen med syre. Science of the Total Environment 689 (2019) 1192-1200. NCBI återhämtade sig.Nlm.Nih.Gov.
- Taninouchi och. och Okabe, T.H. (2018). Återvinning av platina gruppmetaller från förbrukade katalysatorer med hjälp av järnkloridångbehandling. Metall och Materi Trans B (2018) 49: 1781. Länk återhämtat sig.Kandare.com.
- ELLER.S. National Library of Medicine. (2019). Järnklorid. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov.
- Aresta, m. et al. (1977). Järn (0) oxidation med väteklorid i tetrahydrofuran: Enkelt sätt till vattenfritt järn (II) klorid. Oorganisk kemi, volym. 16, nej. 7, 1977. Återhämtat sig från pubar.ACS.org.
- Bomull, f. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- « Portugal Flag History and Meaning (Revided Images)
- Kristen etik ursprung, grundläggande faktorer, representanter »

