Kvaternära föreningar egenskaper, träning, exempel
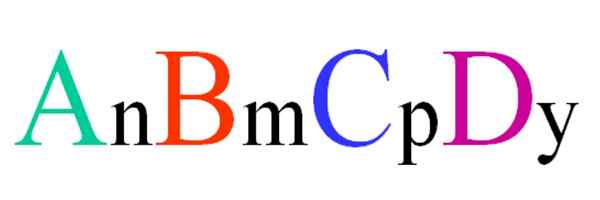
- 3581
- 1031
- Johan Gustafsson
De Kvartära föreningar De är alla som har fyra olika atomer eller joner. Därför kan de vara molekylära eller joniska arter. Dess mångfald täcker både organisk och oorganisk kemi, som är en mycket skrymmande grupp; Även om det kanske inte är så mycket jämfört med binära eller ternära föreningar.
Anledningen till att ditt nummer är mindre beror på att de fyra atomerna eller jonerna måste hållas förenade av deras kemiska affiniteter. Inte alla element är kompatibla med varandra och ännu mindre när de betraktas som en kvartett; Plötsligt är ett par av dem mer relaterade till varandra än med det andra paret.
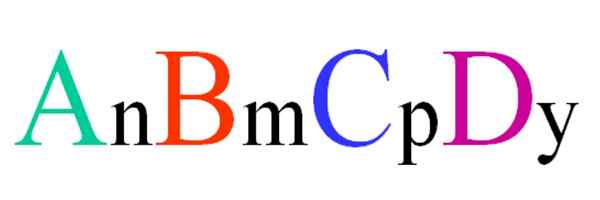 Allmän och slumpmässig formel för en kvartärförening. Källa: Gabriel Bolívar.
Allmän och slumpmässig formel för en kvartärförening. Källa: Gabriel Bolívar. Tänk på en kvartär förening av ABCD: s slumpmässiga formel. Underskrivningarna n, m, p e y, är de stökiometriska koefficienterna, som i sin tur indikerar vilken andel av varje atom det finns i förhållande till de andra.
Således formel anBmCpDoch Det kommer att vara giltigt om det uppfyller elektronutralitet. Dessutom kommer en sådan förening att vara möjlig om deras fyra atomer är tillräckligt nära med varandra. Det kommer att ses att denna formel inte gäller för många föreningar, men särskilt för legeringar eller mineraler.
[TOC]
Egenskaper hos kvartära föreningar
Kemikalier
En kvartärförening kan vara jonisk eller kovalent och uppvisa de förväntade egenskaperna för dess natur. ABCD -joniska föreningar förväntas vara lösliga i vatten, alkoholer eller i andra polära lösningsmedel; De måste ha höga kok- och fusionspunkter och vara bra elförare när de smälter samman.
Beträffande ABCD -kovalenta föreningar består de flesta av kväve, syresatta eller halogenerade organiska föreningar; det vill säga dess formel skulle bli cnHmANTINGENpNoch eller cnHmANTINGENpXoch, X är en halogenatom. Av dessa molekyler skulle det vara logiskt att tro att de var polära, med tanke på de höga elektronegativiteterna för O, N och X.
Kan tjäna dig: natriumklorid (NaCl)En rent kovalent ABCD-förening kan ha många länkmöjligheter: A-B, B-C, D-A, etc., Beroende på atomernas affiniteter och elektroniska förmågor. Medan i en rent jonisk ABCD -förening är dess interaktioner elektrostatiska: a+B-C+D-, Till exempel.
När det gäller en legering, anses mer vara en fast blandning än en förening på ett korrekt sätt, består ABCD av neutrala atomer i basalstillstånd (i teorin).
Av resten kan en ABCD -förening vara neutral, syra eller grundläggande, beroende på identiteten på dess atomer.
Fysisk
Fysiskt sett är det troligt att ABCD inte blir en gas, eftersom fyra olika atomer alltid involverar en större molekylmassa eller formulering. Om det inte är en vätska med en hög kokpunkt förväntas den bli en fast, vars nedbrytning måste generera många produkter.
Återigen, dess färger, lukt, struktur, kristaller, etc., De kommer att bli föremål för hur de samexisterar A, B, C och D i föreningen och kommer att bero på deras synergi och strukturer.
Nomenklatur
Hittills har frågan om kvartära föreningar tagits upp på ett globalt och opriktigt sätt. Lämna organisk kemi åt sidan (Amidas, Benchilo -klorider, kvartära ammoniumsalter, etc.), I oorganisk kemi finns det väldefinierade exempel som kallas sura och grundläggande oxisaler.
Sura oxisaler
Syra oxisaler är de som härstammar från partiell neutralisering av en polyprotisk oxoacid. Således ersätts en eller flera av dess hydrogener av metallkatjoner, och ju mindre kvarvarande väte har, desto mindre sur det kommer att vara.
Till exempel fosforsyra, h3Po4, Upp till två syrasalter kan erhållas från, för att säga, natrium. Dessa är: nah2Po4 (Na+ ersätter en väte som motsvarar h+) och na2Hpo4.
Kan tjäna dig: selen: historia, egenskaper, struktur, erhållning, användningEnligt den traditionella nomenklaturen kallas dessa salter såväl som oxisalerna (helt oskyddade), men föregår ordet "syra" till metallens namn. Således nah2Po4 Det skulle vara natriumdesfosfat och NA2Hpo4 Natriumsyrfosfat (eftersom det har en H har.
Å andra sidan föredrar beståndet nomenklatur att använda ordet "väte" som "syra". Naj2Po4 Det skulle vara att vara natriumdihydrogen och NA2Hpo4 Väte -natriumfosfat. Observera att dessa salter har fyra atomer: na, h, p och o.
Grundläggande oxisaler
Grundläggande oxisaler är de som innehåller anjon OH i deras sammansättning-. Tänk till exempel salt cano3OH (CA2+ NEJ3- Åh-). För att namnge det skulle det räcka för att ge ordet "grundläggande" till metallens namn. Således skulle hans namn vara: grundläggande kalciumnitrat. Och vad sägs om Cuio3Åh? Hans namn skulle vara: Cupric Basic Yodato (CU2+ Io3- Åh-).
Enligt lager nomenklaturen ersätts ordet "grundläggande" av hydroxid, följt av användningen av ett skript före oxoanionens namn.
Upprepa de tidigare exemplen skulle deras namn vara för var och en: kalciumhydroxid-nitrat och kopparhydroxid-andodat (II); Kom ihåg att metallen Valencia måste anges inom parentes och med romerska antal.
Dubbelsalter
I dubbla salter finns det två olika katjoner som interagerar med samma typ av anjon. Anta att det dubbla saltet: CU3Tro (PO4)3 (CU2+ Tro3+ Po43-). Det är ett järn- och kopparfosfat, men det mest lämpliga namnet att hänvisa till detta är: trippel koppar (ii) och järn (iii) fosfat.
Hydratiserade salter
Dessa är hydrater, och den enda skillnaden är att i slutet av deras namn anges antalet vattenformulater. Till exempel MNCL2 Det är manganklorid (II).
Kan tjäna dig: Benzoine: Struktur, egenskaper, användningar och riskerHans hydrat, mncl2· 4h2O Det kallas manganklorid (ii) tetrahydrat. Observera att det finns fyra olika atomer: MN, CL, H och O.
Ett berömt dubbel och hydratiserat salt är Mohr's, Faith (NH4)2(SW4)2· 6h2ANTINGEN. Hans namn är: dubbeljärnsulfat (II) och hexahydratammonium.
Träning
Återigen, med fokus på oorganiska kvartära föreningar, har vi mestadels en produkt av partiella neutraliseringar. Om dessa förekommer i närvaro av flera metalloxider är dubbla salter troliga; Och om mediet är mycket grundläggande kommer de grundläggande oxisalerna att fälla ut.
Och om dessutom, å andra sidan, vattenmolekyler har en affinitet för metall, kommer de direkt att samordna med den eller med de omgivande jonerna och bilda hydraterna.
På legeringens sida måste fyra olika metaller eller metalloider svetsas för tillverkning av kondensatorer, halvledare eller transistorer.
Exempel
Slutligen visas en lista med olika exempel på kvartära föreningar nedan. Läsaren kan använda den för att testa sin kunskap om nomenklatur:
- Pbco3(ÅH)2
- Cr (hso4)3
- Nahco3
- Znioh
- Cu2(ÅH)2Sw3
- Li2Kaso4
- Cuso4· 5h2ANTINGEN
- Agau (så4)2
- Fall4· 2h2ANTINGEN
- Fecl3· 6h2ANTINGEN
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Oorganisk nomenklatur och formulering. [Pdf]. Hämtad från: resurser.utbildning.är
- Erika thalîa bra. (2019). Dubbelsalter. Akademi. Återhämtat sig från: akademin.Edu
- Wikipedia. (2019). Kvartär ammoniumkation. Hämtad från: i.Wikipedia.org

