Egenskaper, träning, exempel
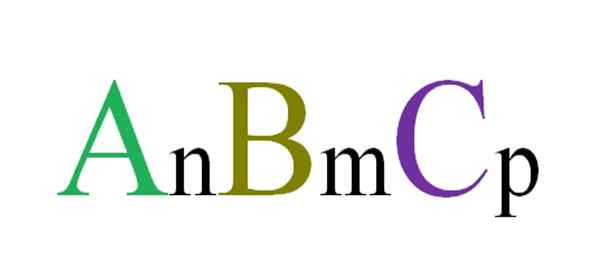
- 2205
- 650
- Prof. Erik Johansson
De Ternära föreningar De är alla som består av tre olika atomer eller joner. De kan vara mycket olika, från syra eller grundläggande ämnen, till metalllegeringar, mineraler eller moderna material. De tre atomerna kan tillhöra samma grupp av den periodiska tabellen, eller fortsätta med godtyckliga platser.
Men för att den ternära föreningen ska inträffa måste det finnas en kemisk affinitet mellan dess atomer. Inte alla är kompatibla med varandra, och därför kan du inte bara välja slumpmässigt vilka tre som kommer att integrera och definiera föreningen eller blandningen (förutsatt bristen på kovalenta bindningar).
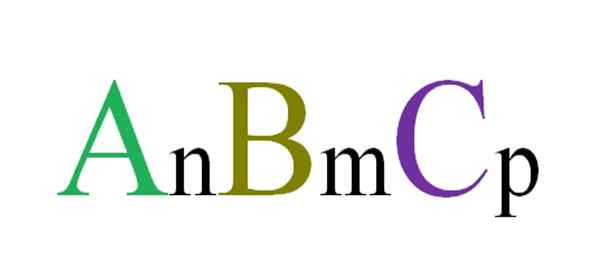 Allmän och slumpmässig formel för ternära föreningar. Källa: Gabriel Bolívar.
Allmän och slumpmässig formel för ternära föreningar. Källa: Gabriel Bolívar. Till exempel väljs tre bokstäver slumpmässigt som kommer att styra en ABC ternär förening (överlägsen bild). Abonnemang n, m och p indikerar stökiometriska förhållanden mellan atomer eller joner a, b och c. Varierande värdena på sådana abonnemang och bokstävernas identitet erhålls oändliga ternära föreningar.
Men formel anBmCp Det kommer bara att vara giltigt om det uppfyller elektronutralitet; det vill säga, summan av dina avgifter måste vara lika med noll. Med detta i åtanke finns det fysiska (och kemiska) begränsningar som leder om bildningen av nämnda ternära förening är möjlig eller inte.
[TOC]
Egenskaper hos ternära föreningar
Dess egenskaper är inte allmänna men varierar beroende på den kemiska karaktären. Till exempel är oxoacider och baser ternära föreningar, och var och en av dem delar eller inte en serie representativa egenskaper.
Nu, före en hypotetisk förening ABC, kan detta vara joniska, om skillnaderna i elektronegativitet mellan A, B och C inte är stora; eller kovalent, med länkar a-b-c. De senare ges i oändliga exempel inom organisk kemi, som med alkoholer, fenoler, etrar, kolhydrater, etc., vars formler kan beskrivas med cnHm ANTINGENp.
Kan tjäna dig: Metallers mekaniska egenskaperSåledes är egenskaperna mycket varierande och oscillerar i den höga graden av en ternär förening till en annan. Föreningen CnHmANTINGENp Det sägs att det är syresatt; Medan CnHmNp, Å andra sidan är det kväve (det är en amin). Andra föreningar kan vara svavel, fosforerade, fluorerade eller ha en markant metallisk karaktär.
Baser och syror
Avancerar inom området oorganisk kemi, du har metallbaser, mnANTINGENmHp. Ge.
Till exempel bör NaOH -basen, med tanke på sådana abonnemang, skrivas som NA1ANTINGEN1H1 (vilket skulle vara kaotiskt). Dessutom skulle det antas att h är som en katjon h+, Och inte hur det verkligen verkar: att vara en del av anjon OH-. På grund av OH- På huden är dessa baser tvålar och kaustiska.
Metallbaserna är joniska ämnen, och även om de består av två joner, mn+ och åh- (Na+ och åh- För NaOH) är de ternära föreningar för att ha tre olika atomer.
Syror, å andra sidan, är kovalenta, och deras allmänna formel är hao, där en icke -metallisk atom vanligtvis är. Men med tanke på att det är lätt att joniseras i vatten som frisätter hydrogener, dess hjoner+ Korroen och skada huden.
Nomenklatur
Liksom egenskaperna är nomenklaturen för de ternära föreningarna mycket varierad. Av den anledningen kommer endast baserna, oxoaciderna och oxisalerna att betraktas som ytligt.
Baser
Metallbaser nämns först med ordet "hydroxid" följt av namnet på metallen och dess valens i romerska antal inom parentes. Således är NaOH natriumhydroxid (I); Men eftersom natriumet har unik valens på +1 förblir det helt enkelt som natriumhydroxid.
Det kan tjäna dig: AlceansAL (OH)3, Till exempel är det aluminiumhydroxid (III); och CU (OH)2, Kopparhydroxid (II). Naturligtvis allt enligt den systematiska nomenklaturen.
Oxoacider
Oxóacider har en ganska allmän formel av HAO -typen; Men i verkligheten beskrivs de bättre som AOH. HA-H: s länk framträder H släpps+.
Den traditionella nomenklaturen är som följer: Ordet "syra" börjar, följt av namnet på den centrala atomen, föregås eller föregås av deras respektive prefix (hypo, per) eller suffix (björn, ICO) enligt huruvida han arbetar med sina minderåriga eller äldre valenser.
Till exempel är bromoxoacider Hbro, Hbro2, Hbro3 och hbro4. Dessa är syror: hypobromous, bromic, bromic respektive perbromisk. Observera att det i alla av dem finns tre atomer med olika värden för sina abonnemang.
Oxisal
Även kallad nullionssalter, de är de mest representativa för ternära föreningar. Den enda skillnaden att nämna dem är att björnen och ICO Sufijos förändras för Ito respektive ATO. Dessutom ersätts H av en metallkation, produkt av syra-basneutralisering.
Fortsätter med brom skulle dess natriumoxisaler vara: nabro, nabro2, Nabro3 och nabro4. Deras namn skulle bli: hipobromito, bromito, bromato och natrium perbromat. Utan tvekan överstiger antalet möjliga oxisaler det för oxoacider.
Träning
Återigen har varje typ av ternär förening sitt eget ursprung eller träningsprocess. Det är emellertid rättvist att nämna att dessa bara kan bildas om det finns en tillräcklig affinitet mellan de tre atommedlemmarna. Till exempel finns metallbaser tack vare elektrostatiska interaktioner mellan katjoner och OH-.
Kan tjäna dig: citronsyraNågot liknande händer med syror, som inte kunde bildas om det inte fanns någon sådan kovalent bindning A-O-H.
Baserat på frågan, hur bildas huvudföreningarna? Det direkta svaret är som följer:
- Metallbaser bildas genom upplösning av metalloxider i vatten eller i en alkalisk lösning (vanligtvis tillhandahålls av NaOH eller ammoniak).
- Oxoacider är produkten av upplösningen av icke -metalliska oxider i vatten; Bland dem CO2, Klo2, NEJ2, Sw3, P4ANTINGEN10, etc.
- Och sedan uppstår oxisaler när oxoacider alkaliseras eller neutraliseras med en metallbas; Från det kommer metallkatjonerna som sätter H+.
Andra ternära föreningar bildas efter en mer komplicerad process, som med vissa legeringar eller mineraler.
Exempel
Slutligen kommer en serie formler för olika ternära föreningar att visas som en lista:
- Mg (OH)2
- Cr (oh)3
- Kmno4
- Na3Bo3
- CD (OH)2
- Äldre bror3
- Feaso4
- Bacr2ANTINGEN7
- H2Sw4
- H2Teo4
- Hcn
- Sedanh
Andra mindre vanliga (och till och med hypotetiska) exempel är:
- Cofecu
- Algasn
- Ucapb
- Bemo2
Abrecripten N, M och P utelämnades för att inte komplicera formlerna; Även i verkligheten är dess stökiometriska koefficienter (förutom det bästa för Bemgo2), kan till och med ha decimalvärden.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- FRU. Hilfstein. (s.F.). Ternary comununds. Återhämtat sig från: tenafly.K12.Nj.oss
- Wikipedia. (2019). Ternary comund. Hämtad från: i.Wikipedia.org
- Carmen Bello, Arantxa Isasi, Ana Puerto, Germán Tomás och Ruth Vicente. (s.F.). Ternära föreningar. Återhämtat sig från: iesdmjac.Utbildare.Aragon.är
- « Kvaternära föreningar egenskaper, träning, exempel
- Specialföreningar Egenskaper, träning, användningar »

